Junio 2014
Editorial Jorge Mendoza
Editorial Jorge Mendoza
We got one last chance to make it real
To trade in these wings on some wheels
Climb in back, heaven’s waiting on down the tracks
Oh oh, come take my hand
We’re riding out tonight to case the promised land
«THUNDER ROAD». Bruce Springsteen
Hace ahora casi un año escribí un editorial, donde se recordaba que «los tiempos están cambiando». Después de muchos meses de trabajo duro, de reuniones y de muchos, muchos cambios, por fin podemos decir que los tiempos han cambiado. Y con estos nuevos tiempos tenemos una nueva página web, una nueva revista y un nuevo impulso para nuestra asociación.
La puesta en marcha de la nueva web hace unos días, pone de manifiesto estos nuevos tiempos. Esta nueva etapa pretende ser mucho más que un lavado de cara, pretende dar un nuevo y potente impulso a la ACAD.
Pero para que todo este impulso se haga realidad, nos hace falta una sola cosa: vuestra colaboración. Tanto la revista, como el resto de la asociación necesitan de vuestros apoyos, de vuestra ayuda y de vuestra colaboración. La nueva página web supone precisamente el punto de encuentro de todos nosotros. Para conocer y hacerse socio, para colaborar en los grupos de trabajo o en el atlas. Para buscar una oferta de trabajo y por supuesto para colaborar en la revista.
Precisamente este es el motivo de este editorial, animaros a colaborar, a consultar los diferentes artículos y a enviarnos vuestros trabajos y comentarios. La nueva web será el punto de encuentro entre la revista y sus lectores, y por supuesto, con sus colaboradores.
Por lo tanto, junto con el nuevo comité editorial os queremos dar la bienvenida a este nuevo viaje, esperamos vuestra colaboración.
Un afectuoso saludo.
Jorge Mendoza Jiménez-Ridruejo
Editor Adjunto Revista ACAD
Fístulas portosistémicas venosas intrahepáticas y poliposis gástrica hiperplásica
Fístulas portosistémicas venosas intrahepáticas y poliposis gástrica hiperplásica
Noelia Alcaide 1, César Herrero 1, Irene Peñas 1, Alba Luz Vargas García 1, Itcíar Anacabe 2, Manuel Pérez-Miranda 1
1 Servicio de Aparato Digestivo. 2 Servicio de Radiología. Hospital Universitario Río Hortega. Valladolid.
PALABRAS CLAVE: fístulas portosistémicas intrahepáticas; poliposis gástrica hiperplásica; malformaciones vasculares hepáticas.
Correspondencia:
Noelia Alcaide Suárez
Servicio de Aparato Digestivo
Hospital Universitario del Río Hortega
C/ Dulzaina 2 • 47012 Valladolid, España
Tfn: 983 42 04 00 ext 84433
noelialcaide@hotmail.com
INTRODUCCIÓN
Las fístulas portosistémicas venosas intrahepáticas (FPVI) no debidas a traumatismo, cirugía o biopsia son raras y se ha establecido un posible origen congénito o adquirido debido a cirrosis e hipertensión portal 1. Actualmente, gracias a los avances en técnicas de diagnóstico por imagen se han diagnosticado un mayor número de casos en pacientes asintomáticos 2.
CASO CLÍNICO
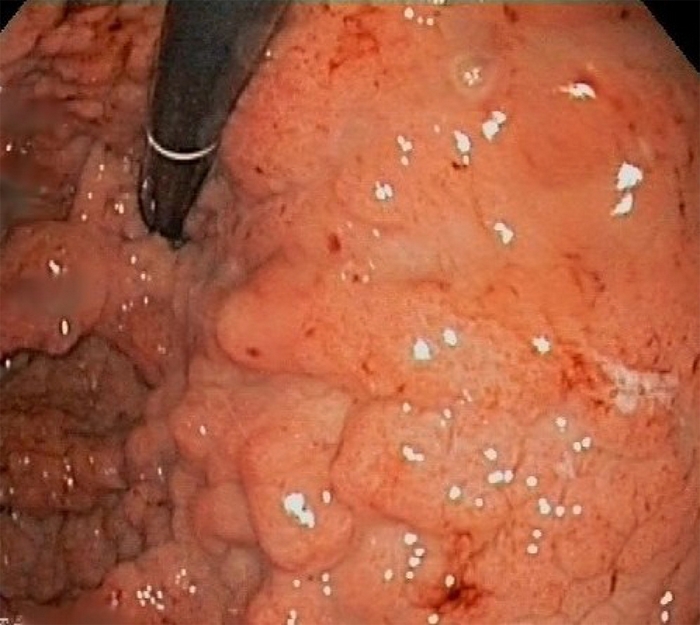
Se presenta el caso de una mujer de 57 años intervenida de adenoma siringomatoso de pezón y gastrectomía total por poliposis hiperplásica gástrica con anemia ferropénica recidivante (Figura 1). Como antecedente familiar de interés, destaca un hermano operado de hiperplasia nodular focal (HNF). En la ecografía abdominal realizada por dispepsia presenta múltiples lesiones hepáticas nodulares difusas de contornos mal definidos. La exploración abdominal y neurológica no muestra ninguna alteración. En la analítica sanguínea, únicamente destaca GGT 51 UI/l y FA 183 UI/l. En la TC abdominal, se visualiza la vena porta principal aumentada de calibre con imágenes de shunts entre ramas portales y venas suprahepáticas de distribución difusa y periférica en ambos lóbulos (Figura 2). En la RM, se identifican múltiples lesiones hepáticas hipervasculares subcapsulares en relación con alteración de la perfusión hepática. Se diagnostica a la paciente de FPVI y dado que no presenta ningún síntoma asociado relacionado, se decide seguimiento sin considerarse ninguna actitud terapéutica.

Figura 1. Imagen endoscópica mostrando el fundus gástrico ocupado de manera difusa por pólipos con signos de hemostasia reciente.

Figura 2. Tomografía computarizada abdominal, cortes axiales del hígado con contraste en fase portal, mostrando shunt periférico entre los sistemas venosos portal y hepático del lóbulo hepático derecho (flechas).
DISCUSIÓN
Las fístulas portosistémicas venosas intrahepáticas (FPVI) constituyen una enfermedad infrecuente y no bien conocida. Park et al clasificaron en 1990 las FPVI publicadas hasta ese momento en 4 tipos diferentes: tipo 1, vaso único de diámetro constante que comunica la vena porta derecha con la vena cava inferior; tipo 2, una o múltiples comunicaciones entre ramas periféricas portales y venas hepáticas en un segmento hepático; tipo 3, una comunicación aneurismática entre ramas portales periféricas y venas hepáticas, y tipo 4, múltiples fístulas entre ramas portales y venas hepáticas de distribución difusa en ambos lóbulos hepáticos 3. De acuerdo con esta clasificación, nuestra paciente presentaba FPVI tipo 4. La mayoría de los casos publicados han sido descritos en mayores de 50 años presentando principalmente los tipos 1 ó 2. Su causa es desconocida, postulando un origen congénito por persistencia de anastomosis embrionarias o adquiridas por cirrosis hepática con hipertensión portal, antecedentes de biopsia hepática, traumatismo o cirugía previa 1. Clínicamente, pueden producir encefalopatía hepática, siendo más frecuente en shunts con un alto débito 4 y en pacientes de mayor edad al tener disminuida la tolerancia del cerebro a metabolitos tóxicos. Actualmente, gracias a los avances en técnicas de diagnóstico por imagen (ecografía Doppler, TC y RM) se han diagnosticado un mayor número de casos en pacientes asintomáticos precisando en algunos casos arteriografía como técnica de confirmación 2. En los pacientes sintomáticos se debe considerar tratamiento percutáneo mediante embolización o tratamiento quirúrgico 5.
En nuestro caso, se propone un posible origen congénito al no presentar datos clínicos ni analíticos de cirrosis hepática ni antecedentes traumáticos y presentando un familiar de primer grado HNF. La HNF se relaciona con una respuesta del parénquima hepático a diferentes malformaciones vasculares hepáticas existiendo en la literatura tres casos de asociación entre ésta y FVPI en un mismo paciente 6, 7,8. Además de las FVPI, se aúnan en nuestra paciente dos enfermedades muy poco frecuentes sin relación entre ellas, poliposis hiperplásica gástrica y adenoma siringomatoso del pezón.
BIBLIOGRAFÍA
- Mayayo Sinués E, Lidón Lorente MC, Fuentes Olmo J, Yagüe Romeo D, Soriano Guillén A, Uribarrena Amezaga R. Fístula aneurismática portohepática venosa espontánea: diagnóstico por imagen. Gastroenterol Hepatol. 2004;27:525-8.
- Golli M, Kriaa S, Said M, Belguith M, Zbidi M, Saad J, et al. Intrahepatic spontaneous portosystemic venous shunt. Value of color and power Doppler sonography. J Clin Ultrasound 2000; 28:47-50.
- Park JH, Cha SH, Han JK, Han MC. Intrahepatic portosystemic venous shunt. Am J Roentgenol 1990;155:527-8.
- Oguz B, Akata D, Balkanci F, Akhan O. Intrahepatic portosystemic venous shunt: diagnosis by colour/power Doppler imaging and three-dimensional ultrasound. Br J Radiol. 2003;76:487-90.
- Filik L, Boyacioglu S. Asymptomatic aneurysmal portosystemic venous shunt: a case report and review of the literature. Acta Medica (Hradec Kralove). 2006;49:241-4.
- Materne R, Van Beers BE. Images in clinical radiology. Spontaneous intrahepatic portohepatic shunt and focal nodular hyperplasia. J Belge Radiol. 1998;81:180.
- Mignon F, Mesurolle B, Cazaban A, Lemesle J. Hyperplasie nodulaire focale et communication porto-porte intrahépatique spontanée. J Radiol. 1996;77:1233-6.
- Lalonde L, Van Beers B, Trigaux JP, Delos M, Melange M, Pringot J.Focal nodular hyperplasia in association with spontaneous intrahepatic portosystemic venous shunt. Gastrointest Radiol. 1992;17:154-6.
Mesotelioma peritoneal maligno: a propósito de un caso
Mesotelioma peritoneal maligno: a propósito de un caso
Marqués-García P, Martínez-Tormo V, Hontangas-Pla V, Gil-Borrás R, Bixquert-Jiménez M.
Departamento de Medicina Digestiva. Hospital Arnau de Vilanova. Valencia. España.
PALABRAS CLAVE: mesotelioma, asbesto, calretinina, quimiote-rapia intraoperatoria, cirugía citorreductora.
Correspondencia:
Pilar Marqués García
Residente de Aparato Digestivo
Hospital Arnau de Vilanova
C/San Clemente 12, 46015. Valencia. España.
Teléfono: 660 531 108
Correo electrónico: marques_pilar@hotmail.com
CASO CLÍNICO
Se trata de una mujer de 56 años, que acude a Urgencias por dolor abdominal. Sin alergias medicamentosas, fumadora de 20 cigarrillos/día, en tratamiento con antihipertensivos y antidepresivos. Como antecedentes quirúrgicos, fue intervenida de histerectomía por miomas uterinos, herniorrafia inguinal, abdominoplastia estética y túnel carpiano bilateral.
Ingresa en el servicio de Digestivo por dolor en hemiabdomen derecho de 5 días de evolución, junto náuseas y vómitos postprandiales. Asocia en el último mes mayor estreñimiento del habitual con deposiciones de características normales, cada 3-4 días. Refiere pérdida de 5 kg en el último mes, junto con astenia y anorexia. A la exploración, sólo destaca palidez mucocutánea, a nivel abdominal dolor a nivel de presenta hemiabdomen derecho, sin signos de irritación peritoneal y hepatomegalia de 2 traveses de dedo. El resto de la exploración física fue anodina.
En las pruebas complementarias: analítica con anemia normocítica hipocrómica, ferropénica (Hb: 11) y VSG: 90. GOT y GPT normales, GGT: 166 y LDH: 479, FA: 174. CEA, Ca19.9 y Ca 12.5 normales. Ca12.5. Gastroscopia y colonoscopia normales. En la ecografía abdominal: esteatosis hepática e imagen heterogénea de 6 x 4.5cm, que podría corresponder a la colección compleja/masa sólido quística en hipocondrio derecho. Se realiza TC toraco-abdominal que confirma masa heterogénea con áreas hipodensas, probablemente de origen necrótico, de 7 x 6 x 5.5 cm que provoca compresión extrínseca aunque sin descartar dependencia de colon transverso/flexura hepática. Posteriormente, se realiza laparotomía exploradora observándose múltiples implantes peritoneales difusos, más numerosos en hipocondrio derecho, diafragma derecho y ligamento redondo. Se practica hemicolectomía derecha englobando la tumoración voluminosa mas resección de implantes en ligamento redondo y la mayor parte de los de hipocondrio derecho, fulgurándose el resto.
Histológicamente se diagnostica la presencia de mesotelioma maligno de 10 x 7 x 5 cm multifocal, que infiltra serosa y grasa pericólica y muscular propia, junto con múltiples nódulos peritoneales tumorales infiltrados por el mismo.
Con estos datos, remitimos a la paciente a Oncología, dado la persistencia de enfermedad abdomino-peritoneal residual. En la tomografía computarizada postoperatoria se observa progresión de enfermedad, dada la presencia de múltiples masas intraabdominales y nódulo hipocaptante de 1.5 cm, de nueva aparición a nivel de cúpula del segmente VII hepático. Inicia tratamiento con quimioterapia de inducción cisplatino (CDDP)-Pemetrexed. Tras el primer ciclo sufre neutropenia grado IV, obstrucción intestinal y posterior insuficiencia respiratoria aguda. A los pocos días se produce el fallecimiento, con alta sospecha de tromboembolismo pulmonar masivo.
DISCUSIÓN
El mesotelioma maligno es un cáncer originado de las células mesoteliales de las superficies serosas: pleura (65-70%), cavidad peritoneal (30%), pericardio y túnica vaginal (1-2%).1 La enfermedad fue descrita por primera vez por Miller y Wynn en 1908. Se trata de una enfermedad rara, aunque en las últimas décadas está aumentando su incidencia, incluso se prevé un pico de incidencia en los próximos 5-20 años. Se calcula 1 caso de cada 1.000.000 de habitantes y año, un tercio son de origen peritoneal. 2,5
El diagnóstico ocurre entre la 4º y 6º década de la vida, con una mayor prevalencia en hombres que en mujeres (probablemente en relación a la exposición ocupacional al asbesto). Jan et al (2006) encontraron diferencias en cuanto al pronóstico según el sexo, obteniendo una supervivencia a los 5 años de 63% en mujeres compa-rada con el 42% de los hombres.3
El asbesto es el primer carcinógeno implicado en la patogénesis del MP, en especial la variedad cridolita.5 El periodo de latencia entre la exposición y la aparición de enfermedad oscila entre 20-30 años, aunque solo el 50% de las personas con MP maligno tienen exposición al asbesto.4
También han sido descritos casos tras radioterapia, exposición a mica, peritonitis recurrente y administración de dióxido de torio. Otras etiologías o cofactores que han sido relacionados con el desarrollo de MP son Simian Virus 40 (SV40), predisposición genética, exposición a otras fibras minerales como heroinita. Otros más raros son la fiebre mediterránea familiar o el linfoma linfocitico difuso.6-7
La clínica suele ser inespecífica en la mayoría de los casos. Según un estudio del Washington Cancer Institute, los pacientes típicamente presentan: dolor abdominal (33%), aumento del perímetro abdominal (31%), herniación (12%), síntomas inespecíficos como anorexia, fiebre, pérdida de peso, disnea, masa abdominal,… En estadios avanzados puede aparecer como obstrucción intestinal, perforación, ascitis, pudiendo requerir cirugía urgente. 8,9,12 Algunos de los síndromes paraneoplásicos que podemos encontrar asociados a MP son: trombocitosis, hipoglucemia, trombosis venosa, ascitis, etc.8
Debemos hacer diagnóstico diferencial con: linfangioma, teratoma quístico, pseudomixoma peritoneal, neoplasias mucinosas quísticas, endometriosis, miosarcoma, fibrosarcoma, rabdomiosarcoma, leiomioma, lipoma, fibroma, tumores metastásicos,… 11,12,13
La localización de las metástasis del MP son hígado, pulmón, corazón, cerebro, tiroides, glándulas suprarrenales, riñones, páncreas, hueso, tejidos blandos, piel y nódulos linfáticos. 3,14
Para el diagnóstico se utilizan técnicas tanto invasivas como no invasivas necesarias para llegar al diagnóstico definitivo de la enfermedad, siendo estas últimas definitivas para llegar al diagnóstico de MP. En cuanto a las no invasivas, los test de laboratorio y marcadores tumorales no suelen ser útiles. Algunos marcadores como CA-125 y CA-153 han sido utilizados para el diagnóstico y seguimiento del MP. 1,6 El CA125 es el que más frecuente se suele elevar en casos de mesotelioma (en el caso que presentamos presentaba unas cifras de 31.2, dentro del rango de la normalidad). CA19.9 y CEA no tienen utilidad. 4 Hay nuevos marcadores, que podrían ser de mayor utilidad en los próximos años, como son el «Serum mesothelin related protein» SMRP y osteopontina (este último con una sensibilidad y especificidad actual de 84.6 y 88.4%. en estudios recientes. 4,6 En los casos que se debutan con ascitis, se debe hacer estudio citológico del líquido ascítico, aunque su valor diagnóstico es muy limitado, ya que raramente obtenemos resultados concluyentes.16 Las pruebas de imagen no son especificas, por lo que debemos recurrir, en la mayoría de los casos, a pruebas invasivas como la laparoscopia para llegar al diagnóstico definitivo. La citología y biopsia no están recomendadas por el riesgo de diseminación del tumor a través del peritoneo.4
En lo referente a la histología, macroscópicamente puede presentarse de forma local o difusa. Típicamente aparece como múltiples nódulos de pequeño tamaño blanquecinos que incluso pueden coalescer formando placas o masas tumorales, pudiendo cubrir todo el peritoneo.1
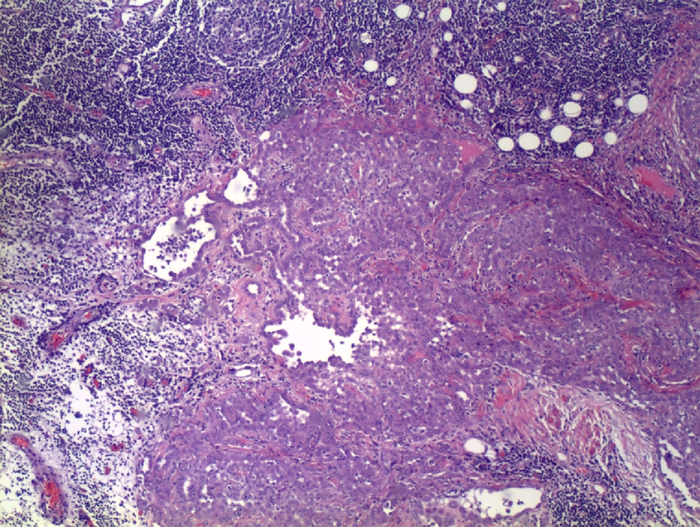
Microscópicamente, podemos dividirlos en 3 subgrupos: epitelial (el más frecuente), sarcomatoide o mixto (bifásico). Lo más frecuente es que aparezcan áreas mostrando los 3 tipos, localizados en un mismo tumor.1 Mediante la tinción de hematoxilina-eosina se consigue llegar a gran parte de los diagnósticos (Figuras 1, 2 y 3). En el tipo epiteliode se observan cordones de células epiteliales, cuboidales y poligonales junto con una matriz mucinosa. El sarcomatoide está compuesto solo por células mesenquimales con forma de huso. En el bifásico podemos encontrar ambos elementos.

Figura 1. Infiltración subserosa de patrón sólido alveolar (He-Eo 10x)

Figura 2. Área de transición zona sarcomatoide con muscular propia del intestino infiltrada (He-Eo 20x)

Figura 3. Patrón sarcomatoide con marcada atipia nuclear (He-Eo 100x)
Inmunohistoquímicamente presenta marcadores positivos como «epithelial membrane antigen» EMA, calretinina, «Wilm’s tumor-1 protein» WT1, citoqueratina 5/6, mesotelina, trombomodulina. Se caracterizan por la negatividad de: CEA, factor de transcripción tiroideo 1, B72.3, MOC-31, Ver-EP4 y B68; junto con positividad para calretinina, citoqueratina y trombomodulina (Figura 4). 15

Figura 4. Positividad intensa para calretinina (40x Inmunohisto-química).
El tratamiento ha evolucionado en los últimos años con la introducción de una nueva terapia combinada de cirugía citorreductora junto con quimioterapia intraperitoneal perioperatoria, quimioterapia intraperitoneal intraoperatoria hipertérmica (QIIH), seguida de quimioterapia intraperitoneal postoperatoria precoz (QIPP), que han demostrado una mediana de supervivencia de 40 a 90 meses a los 5 años.10,15 Los factores pronósticos favorables son: histología no epiteliode, status performance bajo, edad mayor de 75 años, sexo femenino, buen status performance previo, citorreducción completa, bajo índice mitótico del tumor, ausencia de metástasis,… 15,16
REFERENCIAS
- Munkholm-Larsen S, Cao CQ, Yan TD. Malignant peritoneal mesothelioma. World J Gastrointest Surg 2009; 30;1(1):38-48.
- Moore AJ, Parker RJ, Wiggins J. Malignant mesothelioma. Orphanet Journal of Rare Diseases 2008; 3: 34
- Chen LY, Huang LX, Wang J, Qian Y, Fang LZ. Malignant peritoneal mesothelioma presenting with persistent high fever. J Zhejiang Univ Sci B 2011;12(5):381-4.
- Chua TC, Yan TD, Morris DL. Surgical biology for the clinician: peritoneal mesothelioma: current understanding and management. Can J Surg 2009;52(1):59-64.
- Bridda A, Padoan I, Mencarelli R, Frego M. Peritoneal mesothelioma: a review. Med Gen Med 2007;9(2):32.
- Yang XJ, Li Y, Hassan AH, Yang GL, Liu SY, Lu YL et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival in selected patients with peritoneal carcinomatosis from abdominal and pelvic malignancies: results of 21 cases. Ann Surg Oncol 2009;16(2):345-51.
- Rivera Z, Strianese O, Bertino P, Yang H, Pass H, Carbone M. The relationship between simian virus 40 and mesothelioma. Curr Opin Pulm Med 2008;14(4):316-21.
- M Clarke J, Helft P. Long-term survival of a woman with well differentiated papillary mesothelioma of the peritoneum: a case report and review of the literature. J Med Case Rep 2010; 29;4:346.
- Manzini Vde P, Recchia L, Cafferata M, Porta C, Siena S, Giannetta L, Morelli F et al. Malignant peritoneal mesothelioma: a multicenter study on 81 cases. Ann Oncol 2010;21(2):348-53.
- Sugarbaker PH, Acherman Y IZ, González Moreno S, Ortega-Perez G, Anthony Stuart O, Marchettini P et al. Diagnosis and Treatment of Peritoneal Mesothelioma: The Washington Cancer Institute Experience. Seminars in Oncology 2002; 29 (1):51-61
- Pitta X, Andreadis E, Ekonomou A, Papachristodoulou A, Tziouvaras C, Papapaulou L et al. Benign multicystic peritoneal mesothelioma: a case report. J Med Case Rep 2010;29;4:385.
- Shin MK, Lee OJ, Ha CY, Min HJ, Kim TH. Malignant mesothelioma of the greater omentum mimicking omental infarction: A case report. World J Gastroenterol 2009;15(38):4856-9.
- Shao ZH, Gao XL, Yi XH, Wang PJ. Malignant mesothelioma presenting as a giant chest, abdominal and pelvic wall mass. Korean J Radiol 2011;12(6):750-3.
- Pappa L, Machera M, Tsanou E, Damala C, Peschos D, Bafa M et al. Subcutaneous metástasis of peritoneal mesothelioma diagnosed by fine-needle aspiration. Pathol Oncol Res 2006;12(4):247-50.
- Marchevsky AM. Application of immunohistochemistry to the diagnosis of malignant mesotelioma. Arch Pathol Lab Med 2008;132(3):397-401.
- Torrejón Reyes PN, Frisancho O, Gómez A, Yábar A. Malignant peritoneal mesotelioma. Rev Gastroenterol Peru 2010;30(1):82-7.
- Gomez Portilla A, Cendoya I, Muriel J, Olabarria I, Guede N, Moraza N et al. Malignant peritoneal mesothelioma. Our experienced with triple combined therapy: cytoreduction, intraperitoneal perioperative chemotherapy and hyperthermia. Cir Esp 2007;81(2):82-6.
Peritonitis bacteriana secundaria en pacientes con cirrosis hepática
Peritonitis bacteriana secundaria en pacientes con cirrosis hepática
Manzanedo Bueno L1, Velasco Guardado A 2, Piñero Pérez C 2, Calderón Begazo R 2, Jamanca Poma Y 2,
Umaña Mejía J 2, Geijo Martínez F 2, Rodríguez Pérez A 2
1 Servicio de Medicina Interna. 2 Servicio de Aparato Digestivo. Hospital Universitario de Salamanca. Salamanca. España.
Correspondencia:
Pilar Marqués García
Antonio Velasco Guardado
Servicio de Aparato Digestivo
Hospital Universitario de Salamanca
Paseo San Vicente 55-182 • 37007 Salamanca
E-mail: antoniovelascog@usal.es
RESUMEN
La peritonitis bacteriana secundaria (PBS) es la infección del líquido ascítico secundaria a un foco infeccioso intra-abdominal. Se dispone en las últimas dos décadas de un número muy escaso de investigaciones clínicas sobre la PBS en la cirrosis hepática. Diferenciar de manera precoz entre peritonitis bacteriana espontánea y PBS es fundamental de cara al pronóstico del paciente. Ante la sospecha clínica de PBS y tras la punción del líquido ascítico, se debería realizar una TC urgente. En caso de datos de perforación (neumoperitoneo) en las pruebas de imagen, se debería indicar la laparoscopia o la cirugía urgente independientemente del estadio de Child. Si en el TC no hay datos de perforación se puede instaurar tratamiento antibiótico empírico de amplio espectro en espera de evolución, repitiendo la paracentesis diagnóstica cada 48 horas. Presentamos tres casos de pacientes cirróticos con diagnóstico de PBS resueltas de manera conservadora.
PALABRAS CLAVE: peritonitis bacteriana secundaria, cirrosis hepática.
INTRODUCCIÓN
La peritonitis bacteriana secundaria (PBS) es la infección del líquido ascítico secundaria a un foco infeccioso intra-abdominal. Aunque los datos disponibles son escasos, se estima que la PBS en los pacientes cirróticos representa el 10% de las peritonitis y presenta una mortalidad muy elevada (1-3).
A diferencia de lo que ocurre en la peritonitis bacteriana espontánea (PBE), en la PBS existe una pérdida de la integridad del tracto gastrointestinal. Puede ser secundaria a la perforación o a la inflamación aguda de órganos intra-abdominales, por ejemplo una víscera hueca perforada, infecciones de la pared abdominal anterior, procedimientos traumáticos como introducción externa de un material infectado o que posteriormente se infecta. La manifestación clínica más frecuente es el dolor agudo espontáneo, que suele ser difuso a la palpación abdominal y con rigidez de pared, sobre todo si se afecta el peritoneo parietal ricamente inervado. Puede ir acompañado o no de fiebre, taquicardia e hipotensión. Generalmente la analítica objetiva una intensa leucocitosis con neutrofilia y acidosis metabólica. La intensidad y características del dolor abdominal y de la evolución clínica dependerán del proceso causal subyacente y del grado de carga bacteriana en función del área del tubo digestivo comprometido. Es fundamental el diagnóstico precoz mediante pruebas radiológicas con el objetivo de localizar el origen de la contaminación peritoneal y valorar una intervención quirúrgica precoz. La antibioterapia de amplio espectro temprana disminuye la bacteriemia y la formación de abscesos, y previene la diseminación a distancia del proceso (4). El tratamiento antibiótico empírico deberá cubrir los microorganismos más frecuentemente implicados como Gram negativos (Escherichia coli, Klebsiella pneumoniae, Pseudomonas, Proteus o Enterobacter), Gram positivos (Enterococcus y Streptococus viridans) y anaerobios (Bacteroides fragilis, Clostridium sp, Peptostreptococci o Fusobacterium) (5,6). Hay que tener en cuenta que el tratamiento quirúrgico puede ir acompañado de un deterioro significativo en los pacientes cirróticos con estadio avanzado. Por lo tanto, el diagnóstico diferencial precoz y preciso entre PBS y PBE es crucial en estos pacientes.
Las recomendaciones para el diagnóstico diferencial es (7) realizar paracentesis diagnóstica en todos los pacientes cirróticos con ascitis. En base al resultado, podemos diferenciar entre:
- Peritonitis bacteriana espontánea. Recuento de PMN >250/mm3 (en pacientes con ascitis hemorrágica restar 1 PMN por cada 250 hematíes). La mayor sensibilidad para el diagnóstico de PBE se alcanza con un recuento de neutrófilos > 250/mm3, aunque la mayor especificidad es con un límite de 500 neutrofilos/mm3 en líquido ascítico).
- Bacterioascitis: cultivo positivo del líquido ascítico con recuento de PMN<250/mm3 en ausencia de infección local o sistémica.
- Peritonitis bacteriana secundaria. Se sospecha ante:
- Falta de respuesta al tratamiento antibiótico.
- Dos o más microorganismos aislados (fundamentalmente anaerobios y hongos).
- Al menos dos de los siguientes hallazgos (Criterios de Runyon (2)):
- Glucosa <50 mg/dL.
- Proteínas totales en líquido ascítico > 1 g/dL.
- Lactato deshidrogenasa > nivel normal en suero.
A continuación presentamos tres casos de pacientes cirróticos con diagnóstico de PBS resueltas de manera conservadora.
CASOS CLÍNICOS
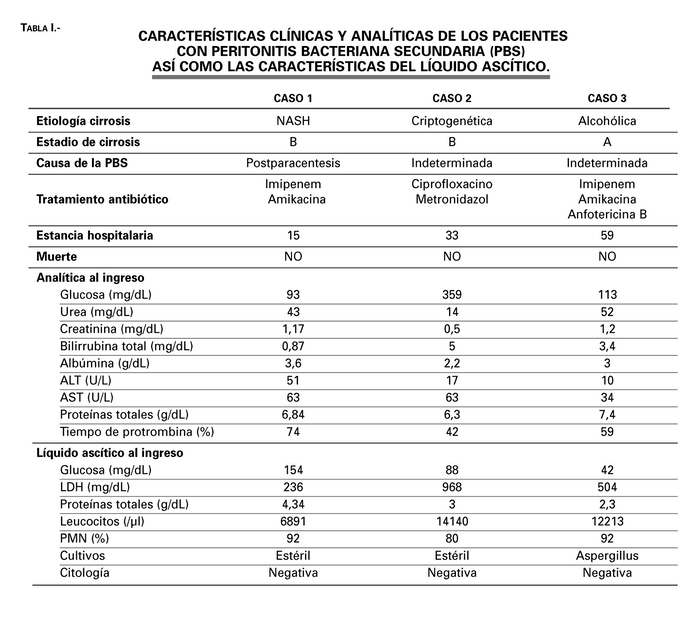
Los datos clínicos, analíticos y del líquido ascítico de cada uno de los casos se muestran en la Tabla I.

Tabla 1. Características clínicas y analíticas de los pacientes con peritonitis bacteriana secundaria (PBS) así como las características del líquido ascítico.
CASO 1
Mujer de 51 años con síndrome metabólico y cirrosis hepática secundaria a esteatohepatitis no alcohólica en estadio B de Child y con varios ingresos previos en nuestro servicio por descompensación edemoascítica. Ingresó de forma programada en el servicio de Digestivo para realización de paracentesis evacuadora por ascitis a tensión refractaria a tratamiento diurético. Se realizó una paracentesis diagnóstica y terapéutica extrayéndose 11 litros de líquido ascítico claro (Gluc 80 mg/dL, LDH 75 mg/dL, Leucocitos 52/µl, PMN 20%) y posteriormente se realizó reposición con albúmina intravenosa. A las 24 horas de la paracentensis la paciente comenzó con intenso dolor abdominal difuso no irradiado con signos de irritación peritoneal, presión arterial (PA) de 90/45 mmHg y frecuencia cardiaca (FC) de 110 latidos por minuto, sin fiebre. Se realizó una tomografía computerizada (TC) urgente en la que se observó abundante líquido libre intraperitoneal perihepático, periesplénico, entre asas y en pelvis, discreta distensión de asas de delgado, sin evidencia de neumoperitoneo, esplenomegalia y colelitiasis sin dilatación de vía biliar intrahepática. Vasos mesentéricos y portales permeables. Ante estos hallazgos y con la sospecha de complicación de la paracentesis previa se llevó a cabo una paracentesis diagnóstica (Tabla I). El cultivo del líquido ascítico fue negativo. Con el diagnóstico probable de peritonitis bacteriana secundaria a iatrogenia de la primera paracentesis se instauró tratamiento antibiótico con Imipenem y Amikacina, con muy buena respuesta clínica y normalización de parámetros analíticos del líquido ascítico, por lo que la paciente fue dada de alta tras 15 días de ingreso hospitalario.
CASO 2
Paciente mujer de 37 años alérgica a penicilinas en seguimiento en consultas de Digestivo, diagnosticada de cirrosis hepática criptogenética en estadio B de Child, que ingresó por cuadro de dolor abdominal difuso de 4 días de evolución con aumento progresivo del perímetro abdominal, vómitos, diarrea, ictericia y fiebre. En la exploración física destacó ictericia cutáneomucosa discreta, postración y afectación por intenso dolor abdominal difuso a la palpación superficial y profunda, ausencia de ruidos intestinales, sin signos de irritación peritoneal. Se realizó paracentesis diagnóstica en la que se obtuvo líquido ascítico con Gluc 88 mg/dL, LDH 986 mg/dL, Proteínas 3.0 g/dL, Leucocitos 14140/µ con 80% PMN. Ante la sospecha de peritonitis bacteriana se inició tratamiento antibiótico empírico con Ciprofloxacino y Vancomicina, y se realizó TC abdominal objetivándose hepatomegalia de contornos lobulados que tras la administración de contraste i.v. mostraba realce heterogéneo, con líquido libre intraperitoneal, perihepático, en gotieras paracólicas y en pelvis, esplenomegalia y circulación colateral. Ante la mala evolución clínica se realizó nuevo TC urgente que informó de la existencia de la pared del colon engrosada y mal definida sugerente de edema inespecífico, sin gas extraluminal ni colecciones que sugieran abscesos. Presentaba captación del peritoneo parietal en relación con peritonitis. Se cambió tratamiento antibiótico a ciprofloxacino más metronidazol con buena respuesta clínica y normalización de parámetros analíticos generales y del líquido ascítico. El cultivo del líquido ascítico, los coprocultivos y la toxina de Clostrium difficile fueron negativos. Se realizó colonoscopia más ileoscopia que objetivó engrosamiento de asas de ileon terminal, con resultado anatomopatológico de proceso crónico inflamatorio inespecífico. La paciente fue dada de alta hospitalaria pendiente de valoración de trasplante hepático ortotópico (THO) tras 33 días de ingreso hospitalario.
CASO 3
Paciente varón de 62 años con cirrosis hepática Child A, de origen enólico y síndrome hepatopulmonar. Ingresó en el servicio de Digestivo por episodio de descompensación hidrópica y fiebre. En la exploración física destacó dolor abdominal leve difuso a la palpación y semiología de ascitis. La paracentesis diagnóstica evidencia líquido ascítico con Gluc 42 mg/dL, LDH 504 mg/dL, Proteínas 2.3 g/dl, Leucocitos 12213/µ, 92% PMN. Se inició antibioterapia empírica con imipenem y se añadió Fluconazol i.v. al tratamiento ante cultivo positivo de orina para Cándida albicans.
Ante la persistencia de la clínica abdominal se realizó un TC en el que se observó ascitis perihepática, en flanco y pelvis, hígado de contornos irregulares con hipertrofia del lóbulo hepático izquierdo y atrofia del derecho, esplenomegalia, páncreas con pequeña calcificación sin significado patológico y colelitiasis múltiple. La Porta era calibre normal con circulación colateral en ligamento gástrico. No se objetivaron signos de perforación ni colecciones intraabdominales.
Posteriormente se realizaron paracentesis seriadas con resultados de líquido infectado a pesar de varios tratamientos empíricos, cultivos reiteradamente negativos y aumento de ADA, por lo que se solicitó Mantoux, Quantiferon en sangre periférica y líquido ascítico siendo todos ellos negativos. Se procedió a la realización de una laparoscopia exploradora para toma de biopsia peritoneal ante la sospecha de tuberculosis y se inició tratamiento antituberculoso. Tras la laparoscopia el paciente sufrió un deterioro significativo, con encefalopatía y aparición de nuevo de fiebre, junto con insuficiencia respiratoria aguda, motivo por el que precisó ingreso en UCI. Se aisló finalmente en el líquido ascítico una sola colonia de Aspergillus fumigatus. Presentó buena evolución tras añadirse al tratamiento con Imipenem y Amikacina, Anfotericina B. El paciente fue dado de alta tras 59 días de estancia hospitalaria.
DISCUSIÓN
Se dispone en las últimas dos décadas de un número muy escaso de investigaciones clínicas sobre la PBS en la cirrosis hepática. Diferenciar de manera precoz entre PBE y PBS es fundamental de cara al pronóstico del paciente.
El dolor abdominal ocasionado por la PBS es más intenso que en la PBE, debido en parte al mayor proceso inflamatorio local (mayor leucocitosis, LDH más alta y glucosa baja) (2, 8-10) y al mayor paso de bacterias. Debido a este hecho, la rentabilidad de la tinción del gram y el cultivo es mayor en la PBS que en la PBE (11). Otros datos que sugieren el diagnóstico de PBS son el cultivo polimicrobiano y la presencia de anaerobios u hongos (2, 8, 9, 11-13).
La rentabilidad diagnóstica de los criterios de Runyon varía de unos estudios a otros, con una sensibilidad entre el 66.6% y el 97% y la especificidad entre 56% y 89.6% (8-10), por lo que se han estudiado otros parámetros cuya elevación parece ser más específica en la PBS a perforación intestinal. En este sentido, Wu et al (9), utilizaron el antígeno carcinoembrionario (CEA) presente en enterocitos del colon, y la fosfatasa alcalina (FA) del tracto gastrointestinal para concluir que elevaciones de dichos parámetros en líquido ascítico probablemente no son resultado de cambios inflamatorios, sino más bien marcadores específicos para la perforación intestinal. Así pues, un líquido ascítico con FA > 240 U/l, ó CEA> 5 ng/ml, reflejará en el 80% de los casos peritonitis secundaria (14). Aunque no hay datos disponibles sobre la exactitud diagnóstica de esta combinación de criterios, el cumplimiento de cualquiera de los parámetros de Wu, junto con los criterios de Runyon, probablemente mejoren la sensibilidad y especificidad. El diagnóstico definitivo de peritonitis bacteriana secundaria se realiza mediante pruebas de imagen, cirugía o datos de la autopsia (2,8,9). El diagnóstico precoz de PBS permite instaurar tratamiento antibiótico empírico de amplio espectro y realizar una valoración por cirugía antes de que se instaure la respuesta inflamatoria sistémica que provoque el deterioro clínico del paciente.
En el estudio de Akriviadis y Runyon (8) la mortalidad de la PBS fue del 53% y fue independiente del estadio de Child. En 2010, Soriano y colaboradores (10), presentaron una investigación retrospectiva de 24 pacientes con PBS, realizada en dos hospitales de tercer nivel en España, durante un período observacional de siete años. La mortalidad de la PBS fue superior a la mortalidad de la PBE. En el estudio de Soriano, la mortalidad de la PBS fue del 66.6% frente al 26.4% de la PBE, independientemente de la etiología y/o la gravedad de la cirrosis. La mortalidad fue más baja (53.8%) en pacientes con PBS intervenidos quirúrgicamente frente a los que sólo recibieron tratamiento médico (81.8%) aunque estas diferencias no fueron estadísticamente significativas. Todos los pacientes con peritonitis bacteriana secundaria a perforación no operados murieron. La mortalidad fue menor en los pacientes intervenidos que en los que se realizó tratamiento conservador. Sin embargo, el tiempo entre la paracentesis y el diagnóstico de PBS fue superior en el grupo de pacientes fallecidos. Este dato junto con una presión arterial media menor en los pacientes fallecidos, hacen suponer, que el factor más importante para la supervivencia del paciente es la rápida instauración de un tratamiento eficaz, ya sea médico o quirúrgico, antes de que se instaure la respuesta inflamatoria sistémica o la sepsis.
En los casos presentados, llama la atención que ningún paciente falleció, probablemente debido a que ninguno de ellos presentaba datos de perforación en las pruebas de imagen. Ante la sospecha clínica de PBS y tras la punción del líquido ascítico, se debería realizar una TC urgente. En caso de datos de perforación (neumoperitoneo) en las pruebas de imagen, se debería indicar la laparoscopia o la cirugía urgente independientemente del estadio de Child. Si en el TC no hay datos de perforación se puede instaurar tratamiento antibiótico empírico de amplio espectro en espera de evolución, repitiendo la paracentesis diagnóstica cada 48 horas.
BIBLIOGRAFÍA
- Fernández J, Navasa M, Gómez J, Colmenero J, Vila J, Arroyo V, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35:140–8.
- Runyon BA, Hoefs JC. Ascitic fluid analysis in the differentiation of spontaneous bacterial peritonitis from gastrointestinal tract perforation into ascitic fluid. Hepatology 1984; 4:447–50.
- Castellote J, López C, Gornals J, Tremosa G, Fariña ER, Baliellas C. Rapid diagnosis of spontaneous bacterial peritonitis by use of reagent strips. Hepatology 2003; 37:893–6.
- Wong PF, Gilliam AD, Kumar S, Shenfine J, O’Dair GN, Leaper DJ. Antibiotic regimens for secondary peritonitis of gastrointestinal origin in adults. Cochrane Database Syst Rev 2005(2):CD004539.
- Solomkin JS, Mazuski JE, Bradley JS, Rodvold KA, Goldstein EJ, Baron EJ, et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Surg Infect (Larchmt) 2010 Feb;11(1):79-109.
- Wittmann DH, Schein M, Condon RE. Management of secondary peritonitis. Ann Surg 1996 Jul;224(1):10-8.
- Rimola A, Garcia-Tsao G, Navasa M, Piddock LJ, Planas R, Bernard B, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000 Jan;32(1):142-53.
- Akriviadis EA, Runyon BA. Utility of an algorithm in differentiating spontaneous from secondary bacterial peritonitis. Gastroenterology 1990;98:127–33.
- Wu SS, Lin OS, Chen YY, Hwang KL, Soon MS, Keeffe EB. Ascitic fluid carcinoembryonic antigen and alkaline phosphatase levels for the differentiation of primary from secondary bacterial peritonitis with intestinal perforation. J Hepatol 2001 Feb;34(2):215-21.
- Soriano G, Castellote J, Alvarez C, Girbau A, Gordillo J, Baliellas C, et al. Secondary bacterial peritonitis in cirrhosis: a retrospective study of clinical and analytical characteristics, diagnosis and management. J Hepatol 2010 Jan;52(1):39-44.
- Runyon BA, Canawati HN, Akriviadis EA. Optimization of ascitic fluid culture technique. Gastroenterology 1988;95:1351–5.
- Runyon BA, Hoefs JC. Spontaneous vs. secondary bacterial peritonitis. Differentiation by response of ascitic fluid neutrophil count to antimicrobial therapy. Arch Int Med 1986;146:1563–5.
- Castellote J, Xiol X, Verdaguer R, Ribes J, Guardiola J, Giménez A, et al. Comparison of two ascitic fluid culture methods in cirrhotic patients with spontaneous bacterial peritonitis. Am J Gastroenterol 1990;85:1605–8.
- Fernández J, Navasa M, Planas R, Montoliu S, Monfort D, Soriano G, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007;133:818–24.
Infarto idiopático del omento menor: diagnóstico diferencial de masa dolorosa en epigastrio
Infarto idiopático del omento menor: diagnóstico diferencial de masa dolorosa en epigastrio
Martín V 1, Marinero A 1, Caldas M 1, Aguilar M 2
1 Servicio de Aparato Digestivo. 2 Servicio de Urgencias. Hospital Universitario de La Princesa, Madrid, España.
Correspondencia:
Verónica Martín Domínguez
Servicio de Aparato Digestivo
Hospital Universitario de La Princesa
C/ Diego de León, 62 • 28006 Madrid, España
Teléfono: 673 831 093
E-mail: veronicamartin29@yahoo.es
RESUMEN
Introducción. El infarto del omento (IO) es una rara causa de dolor abdominal agudo, que puede ocurrir en cualquier localización del abdomen. Es más frecuente el IO mayor, siendo extremadamente infrecuente en el menor. Se han comunicado menos de 10 casos en la bibliografía médica y en todos ellos se presentado con clínica de dolor en epigastrio.
Caso Clínico. Se trata de mujer de 39 años de edad que acudió a urgencias por dolor abdominal, destacando en exploración física, la presencia de una masa en epigastrio. El diagnóstico diferencial se hizo con enfermedad úlcero-péptica y una tumoración adyacente al páncreas, observada por ecografía abdominal. La gastroscopia mostró una masa submucosa vs compresiva extrínseca en el estómago, y la ecoendoscopia fue normal. El diagnóstico definitivo de IO se realizó a través de tomografía computarizada (TC), la cual identificó una masa heterogénea en la transcavidad de los epiplones, con imágenes hiperatenuadas en su interior, habiéndose descartado otras posibles etiologías. El manejo fue conservador y la evolución clínica y radiológica fue favorable.
Conclusión. El IO menor, a pesar de su baja frecuencia debe ser incluido dentro de los diagnósticos diferenciales del dolor abdominal y masa en epigastrio, cuando se hayan descartado las causas más habituales. Alcanzar un diagnóstico de certeza (a través de TC o ecografía) es indispensable para establecer el tratamiento adecuado, por lo que es de vital importancia el reconocimiento de esta patología. El manejo conservador estuvo indicado en todos los casos de IO menor conocidos, incluida nuestra paciente con evolución favorable, por lo cual consideramos que se debe reservar la cirugía para los casos en los que el diagnóstico radiológico sea incierto o el deterioro clínico lo precise.
PALABRAS CLAVE: infarto idiopático; omento menor; masa epigastrio; trabeculación grasa.
ABREVIATURAS: infarto del omento (IO), tomografía computarizada (TC), proteína C reactiva (PCR), resonancia magnética (RM)
INTRODUCCIÓN
El omento o epiplón es un repliegue peritoneal que depende del peritoneo visceral del estómago y del colon transverso; contiene grasa y vasos sanguíneos, así como ganglios linfáticos, siendo su función la contención de infecciones intraperitoneales. Anatómicamente está dividido en epiplón mayor y menor. El omento menor está formado por los ligamentos gastrohepático y el hepáticoduodenal, que conecta la curvatura menor del estómago y el duodeno proximal con el hígado (1). El infarto del omento (IO) menor es una entidad muy poco frecuente que se ha descrito recientemente en la bibliografía médica, gracias a los avances en técnicas radiológicas de los últimos años y al afinamiento en su reconocimiento clínico y radiológico. Se han descrito múltiples asociaciones etiológicas, sin embargo su patogénesis es aún desconocida. A continuación se presenta un caso de IO menor idiopático, que se manifestó como una masa dolorosa en epigastrio, cuyo manejo fue conservador y la evolución clínica y radiológica resultó favorable.
CASO CLÍNICO
Se trata de una mujer de 39 años, sin antecedentes médicos de interés, quien acudió a urgencias por dolor en epigastrio superior, de 3 días de evolución, no irradiado, que se modificaba con los movimientos del tronco y asociado a náuseas y vómitos ocasionales. En ningún momento presentó fiebre. A la exploración física se palpaba en epigastrio: una masa redondeada, adherida a planos, de 4 cm aproximadamente.
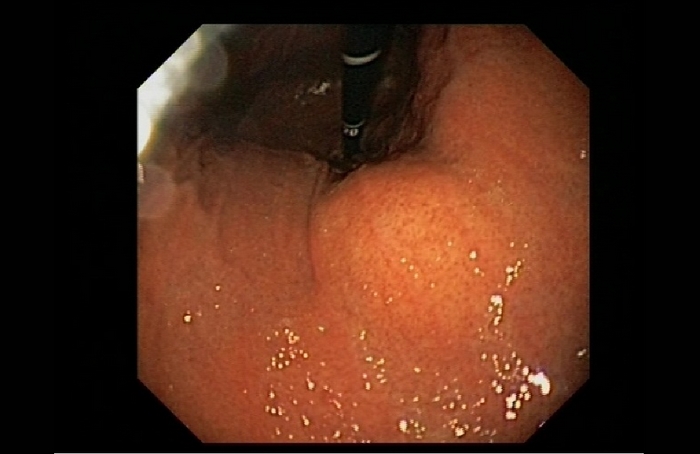
La ecografía abdominal reveló que se trataba de una lesión adyacente al páncreas. En la tomografía computarizada (TC) se identificó una masa de 33x20x40 mm, en la transcavidad de los epiplones, de características inflamatorias, más hiperdensa que la grasa mesentérica, que producía una ligera impronta sobre la pared posterior del estómago, sin distinguir un claro plano de clivaje. Se identificaron pequeñas imágenes lineales hiperdensas en su interior, sugestivas de vasos sanguíneos (Figura 2). Los diagnósticos diferenciales fueron: tumor peripancreático; trabeculación de la grasa peripancreática; tumoración estromal o inflamación focal de la pared gástrica (ejemplo úlcera gástrica). Se realizó una gastroscopia, en la que se apreció una tumoración compresiva extrínseca en la cara posterior gástrica (Figura 1), y una ecoendoscopia que fue normal. Finalmente, habiéndose descartado causas inflamatorias/tumorales pancreáticas y de la pared gástrica, se propuso el diagnóstico de IO menor y se estableció tratamiento conservador con analgésicos no esteroideos. Al 4º día de ingreso la paciente se encontraba asintomática, siendo dada de alta. Al cabo de un mes se realizó resonancia magnética abdominal (RM), que mostró una imagen que no captaba contraste intravenoso de alteración residual, en zona del ligamento gastrohepático, confirmándose la sospecha del IO menor, con evolución radiológica favorable.

Figura 1. Imagen de gastroscopia en la que se aprecia tumoración compresiva extrínseca en cara posterior del estómago (vista en retrovisión) Área de transición zona sarcomatoide con muscular propia del intestino infiltrada (He-Eo 20x)


Figura 2. Imágenes de la TC sin contraste (A) coronal y (B) axial, que muestran el área focal de hiperatenuación de la grasa omental.
DISCUSIÓN
El IO es una causa poco frecuente de dolor abdominal agudo, descrito por primera vez en 1999, por van Breda Vriesmann et al, siendo el resultado del infarto de la grasa omental focal (2).
Frecuentemente se produce secundario a cirugía abdominal, pero también puede ocurrir de forma idiopática o primaria. La patogénesis es aún desconocida, sin embargo se han postulado varias hipótesis, tales como: malformaciones vasculares durante el desarrollo embriológico; variaciones en la distribución de la grasa; estasis venosa o congestión vascular y trombosis, que comprometen el aporte de los vasos sanguíneos, y hacen al omento susceptible de torsión o infarto espontáneo (3). Factores precipitantes son: los incrementos de la presión abdominal, por ejemplo, secundarios a comidas copiosas; los estados de hipercoagulabilidad; cirugías abdominales, y la obesidad(4). Puede ocurrir en cualquier localización del abdomen, siendo clínicamente indistinguible de otras entidades, como: apendicitis, colecistitis, ulcera péptica, diverticulitis (2). El IO suele estar acompañado de síntomas inespecíficos, como náuseas y vómitos. En la analítica puede haber aumento de los reactantes de fase aguda, como leucocitosis o elevación de la proteína C reactiva (PCR) (5). Es más frecuente el IO mayor, pero, de forma excepcional puede ocurrir el IO menor, manifestándose como dolor localizado en epigastrio, con defensa abdominal y en ocasiones con signos de irritación peritoneal, como lo fue el caso clínico descrito, quien además presentó el hallazgo de una masa palpable (3, 6).
La TC es el principal método diagnóstico, tanto para el IO mayor como el IO menor, cuya sensibilidad es del 90%. Los hallazgos tomográficos son: una lesión circunscrita, heterogénea, de atenuación mixta que muestra trabeculación grasa, con imágenes lineales hiperdensas en su interior, correspondientes a bandas fibrosas y/o venas trombosadas dilatadas (3, 5). La ecografía tiene una sensibilidad del 64% y se muestra como una masa heterogénea, mal definida, con focos internos de hiper e hipoecogenicidad, no compresible (7). Tanto la TC como la ecografía contribuyen a descartar otros procesos primarios causantes de masas benignas en el epiplón, como: tumor estromal, hemangioma, tumor neurogénico y teratoma; así también procesos malignos: linfomas y enfermedades metastásicas.
También se ha empleado la RM en casos de IO mayor, mostrando, en secuencias potenciadas en T1, una lesión hipointensa con áreas hiperintensas que corresponden a grasa y a restos hemáticos. La RM se ha empleado principalmente en el seguimiento imagenológico, mostrando un anillo hiperdenso bien definido. En nuestro paciente se empleó la RM para el control radiológico, mostrando la evolución favorable de la lesión.
En una revisión de la bibliografía (PubMed), encontramos 8 casos de IO menor, descritos desde el 2004 hasta el 2012 (8). Todos los pacientes mostraban, como síntoma principal, dolor abdominal, y algunos de ellos presentaban leucocitosis. No encontramos diferencia en cuanto a sexo ni edad de los pacientes. El diagnóstico se realizó a través de TC y en ningún caso se efectuó gastroscopia ni ecoendoscopia, y la etiología fue idiopática. El diagnóstico diferencial se estableció con enfermedad ulcero-péptica y pancreatitis. Todos los pacientes fueron manejados con éxito, de forma conservadora.
Existe controversia entre el manejo conservador y el quirúrgico. El tratamiento conservador está justificado, debido al curso autolimitado en el 90% de los casos. Consiste en el ingreso hospitalario bajo vigilancia de los síntomas, control del dolor con fármacos analgésicos y antiinflamatorios, un adecuado aporte de fluidos y disminución de la ingesta. El tratamiento con antibiótico aún está en discusión. Algunos autores recomiendan el tratamiento quirúrgico, bien sea cirugía abierta o laparoscópica, con resección de la zona de isquemia; debido a que acorta el periodo hospitalario, disminuye el requerimiento de analgesia por el paciente y evita el riesgo de formación de adherencias, abscesos o sepsis. Sin embargo, otros autores afirman que este riesgo es teórico, siendo mayor el de complicaciones derivadas de la cirugía y el riesgo anestésico (5, 9).
Todos los casos encontrados de IO menor publicados hasta la fecha, han sido manejados de forma conservadora, sin presentar complicaciones, y se encontraron asintomáticos, en una media de 2 semanas; sin embargo, no podemos realizar un análisis comparativo con el tratamiento quirúrgico.
CONCLUSIÓN
El IO menor debe ser incluido dentro de los diagnósticos diferenciales del dolor abdominal y masa en epigastrio, cuando se han descartado las causas más frecuentes. El diagnóstico definitivo, a través de TC o ecografía, es indispensable para establecer el tratamiento adecuado, por lo que es de vital importancia el conocimiento de esta patología, así como afinar los criterios radiológicos para su reconocimiento. El manejo conservador estuvo indicado en todos los casos de IO menor conocidos, incluida nuestra paciente, con evolución favorable, por lo que se reserva la cirugía para los casos en los que el diagnóstico radiológico sea incierto o el deterioro clínico lo precise.
BIBLIOGRAFÍA
- Coulier B. Contribution of us and ct for diagnosis of intra peritoneal focal fat infarction (IFFI): a pictorial review. J Belg Radiol 2010;93:171-84.
- van Breda Vriesman AC, Lohle PN, Coerkamp EG, Puylaert JB. Infarction of omentum and epiploic appendage: diagnosis, epidemiology and natural history. Eur Radiol 1999;9:1886-92.
- Pereira JM, Sirlin CB, Pinto PS, Casola G. CT and MR Imaging of Extrahepatic Fatty Masses of the Abdomen and Pelvis: Techniques, Diagnosis, Differential Diagnosis, and Pitfalls. RadioGraphics 2005;25:69-85.
- Fernández-Rey CL. Primary omental infarction as cause of non-surgical acute abdomen: imaging diagnose. Rev Esp Enferm Dig 2010; 102(8):498-99.
- Park TU, Oh JH, Chang IT, Lee SJ, Kim SE, Kim CW, et al. Omental infarction: case series and review of the literature. J Emerg Med 2012; 42(2):149-54.
- Soobrah R, Badran M, Smith SG. Conservative Management of Segmental Infarction of the Greater Omentum: A Case Report and Review of Literature. Case Rep Med 2010;2010:765389.
- Rimon A, Daneman A, Gerstle JT, Ratnapalan S. Omental infarction in children. J Pediatr 2009 Sep;155(3):427-31
- Coulier B, Van Hoof M. Intraperitoneal fat focal infarction of the lesser omentum: case report. Abdom Imaging 2004;29(4):498-501.
- Barai K, Knight b. Diagnosis and management of idiopathic omental infarction: A case report. Int J Surg Case Rep 2011; 2(6):138–40.
Úlcera péptica duodenal simulando cáncer
Úlcera péptica duodenal simulando cáncer
Alcaide N, Ruiz-Zorrilla R, Sancho del Val L, Barrio J, de la Serna-Higuera C, Pérez-Miranda M
Servicio de Aparato Digestivo. Hospital Universitario Río Hortega. Valladolid.
Palabras clave: úlcera péptica; úlcera duodenal; masa inflama-toria; neoplasia.
Correspondencia:
Noelia Alcaide Suárez
Servicio de Aparato Digestivo
Hospital Universitario del Río Hortega
C/ Dulzaina 2 • 47012 Valladolid, España
Tfn: 983 42 04 00 ext 84433
noelialcaide@hotmail.com
Sr Director:
La úlcera péptica es el resultado de un desequilibrio entre los factores agresivos y los factores defensivos de la mucosa gastroduodenal. Sus cuatro complicaciones más frecuentes son: hemorragia, perforación, obstrucción y penetración. En la actualidad, ha disminuido sustancialmente la frecuencia de la úlcera péptica y, por tanto, sus complicaciones debido al uso de inhibidores de la bomba de protones en la población general y sobre todo, en pacientes pluripatológicos polimedicados 1.
CASO CLÍNICO
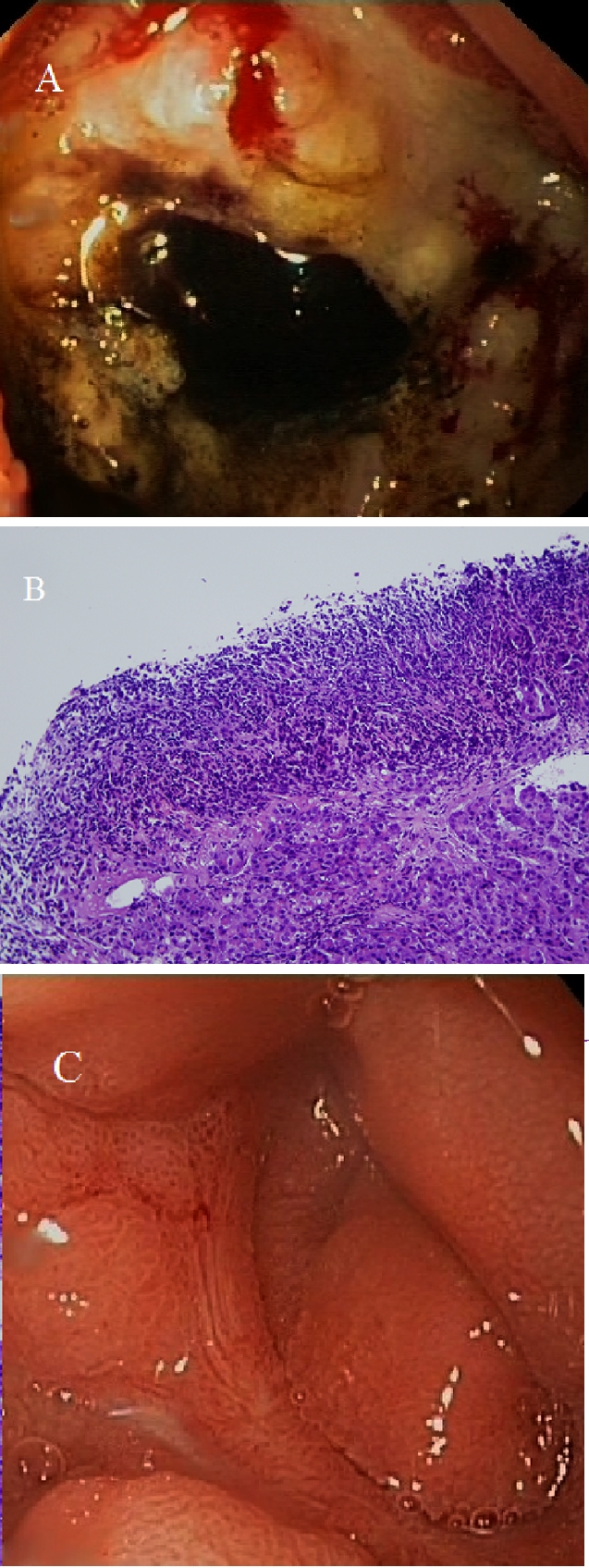
Se describe el caso de una mujer de 47 años que ingresa en nuestra unidad por dolor abdominal en epigastrio, astenia y pérdida de 10 kg de peso de siete meses de evolución. La paciente no tenía antecedentes personales de interés. En la exploración física, destaca palidez mucocutánea y masa en epigastrio dolorosa a la palpación. En la analítica, presenta anemia microcítica e hipocrómica con resto de hemograma, coagulación y bioquímica sin alteraciones. En la gastroscopia, se observa una lesión ulcerada y necrótica de aspecto maligno en bulbo duodenal ocupando la totalidad de la circunferencia (Figura 1A). La Tomografía Computarizada (TC) muestra un engrosamiento de la pared duodenal hasta antro con pobre diferenciación de la grasa adyacente en relación con infiltración tumoral y ganglios linfáticos inespecíficos. En la ecoendoscopia se observa una masa irregular duodenal que se extiende a antro con infiltración de la adventicia sin plano de separación con la cabeza de páncreas. Se realizan dos estudios histológicos con sendos diagnósticos de úlcera duodenal penetrada a páncreas sin signos de malignidad mostrando infiltrado inflamatorio, áreas de necrosis, depósitos de fibrina y acinos pancreáticos en la base de la úlcera (Figura 1B). Tras dos biopsias negativas para células tumorales malignas, a pesar de la sospecha inicial de malignidad, se diagnostica a la paciente de úlcera duodenal penetrada a páncreas decidiéndose tratamiento con inhibidores de la bomba de protones y tratamiento erradicador para Helicobacter pylori. Dos meses después, una gastroscopia de control evidencia una cicatriz postulcerosa en bulbo duodenal completamente epitelizada, sin lesiones agudas (Figura 1C) y la TC una marcada disminución en el tamaño de las lesiones.

Figura 1. A Lesión ulcerada y necrótica en bulbo duodenal de aspecto maligno en la gastroscopia.
B Imagen histológica que muestra infiltrado inflamatorio, áreas de necrosis, depósitos de fibrina y acinos pancreáticos en la base de la úlcera.
C Cicatriz postulcerosa en bulbo duodenal sin lesiones agudas tras el tratamiento médico.
DISCUSIÓN
El hallazgo de una úlcera péptica simulando una masa abdominal de aspecto maligno con penetración en el tejido adyacente es infrecuente 2-3. Las complicaciones más frecuentes de las úlceras pépticas son la hemorragia y la perforación siendo desconocida la frecuencia actual de complicaciones que pueden comprometer la vida del paciente. En este caso, a pesar de los síntomas de la paciente y de los datos de malignidad en las exploraciones complementarias realizadas, la negatividad de las biopsias y la regresión de las lesiones tras el tratamiento médico, nos permitió realizar el diagnóstico de certeza de úlcera péptica penetrada a páncreas y evitar una intervención quirúrgica. Un error en el diagnóstico podría haber dado lugar a un procedimiento invasivo innecesario.
BIBLIOGRAFÍA
- Milosavljevic T, Kostiç-Milosavljeviç M, Jovanoviç I, Krstiç M. Complications of peptic ulcer disease. Dig Dis 2011;29:491-3.
- Mai AL, Mai KT. Fine-needle aspiration biopsy of an intra-abdominal inflammatory mass secondary to a penetrating duodenal ulcer mimicking neoplasm. Diagn Cytopathol 2001;25:301-2.
- Hidalgo L, Repiso A, Romero M, Navajas J, Sánchez-Simón R, Gómez-Rodríguez R, Carrobles JM. Obstructive jaundice as a complication of a peptic duodenal ulcer mimicking pancreatic cancer. Endoscopy 2010;42 Suppl 2:E294-5.
Achalasia secundaria a colocacion de banda gástrica
Achalasia secundaria a colocacion de banda gástrica
Barreiro Fernández A (1), Plaza Santos R (1), Tejedor Bustos Á (1), Ponferrada Díaz A (1), Barceló López M (1),
Martín Chavarri S (1), Gil Gil Fuensanta (2), García Gomez J M (3), Gimeno Aranjuez M (4), Aldeguer Martínez M (1)
1 Servicio de Aparato Digestivo. 2 Servicio de Radiología. 3 Servicio de Medicina Interna.
4 Anatomía Patológica. Hospital Infanta Leonor. Madrid.
Correspondencia:
Asunción Barreiro Fernández
Servicio de Aparato Digestivo
Hospital Infanta Leonor
c/ Gran vía del Este nº 80 • 28031 Madrid.
Tel.: 616 537 202
asunción.barreirof@salud.madrid.org
RESUMEN
Presentamos el caso de una paciente joven con antecedente de colocación de banda gástrica 4 años antes estudiada por vómitos y disfagia progresiva para sólidos y líquidos. La gastroscopia muestra cardias hipertónico con resistencia al paso del endoscopio y en retroversión protrusión a nivel cardial de la banda gástrica. El estudio manométrico mostró terciarismo a nivel de los dos tercios distales del esófago, confirmado con radiología esofagogastroduodenal que muestra dilatación esofágica sin claro afilamiento distal. Con el diagnostico de acalasia secundaria a deslizamiento proximal de banda gástrica la paciente es intervenida para retirada de la banda quedando desde entonces asintomática.
PALABRAS CLAVE: achalasia, banda gastrica, manometria
Sr Director:
La banda gástrica, desde su aparición hace más de 20 años (Molina y Kolle en 1980) se ha convertido en una herramienta importante en el tratamiento y gestión a largo plazo de la obesidad mórbida. A pesar de que es segura, no está exenta de efectos secundarios: dilatación o herniación gástrica por encima de la banda, erosión o inclusión intragástrica de la misma, problemas del reservorio y trastornos motores esofágicos (1-8).
CASO CLÍNICO
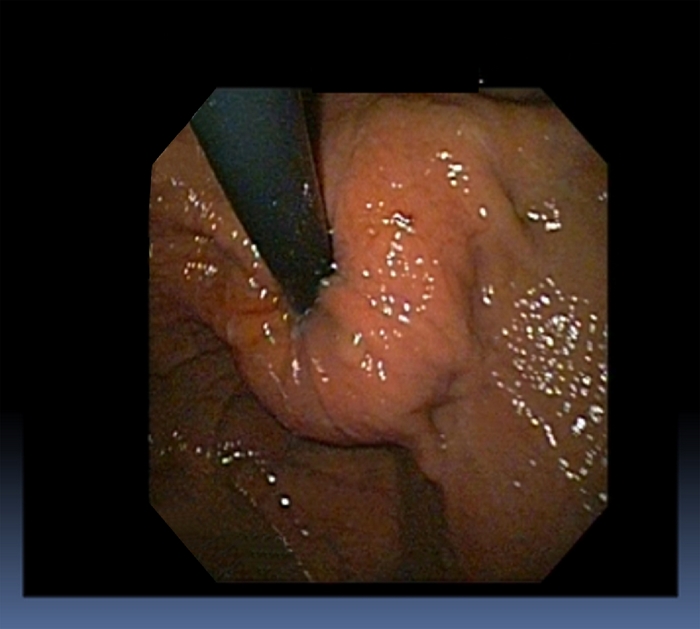
Mujer de 35 años portadora de Factor V de Leiden con trombosis venosa profunda en el 2007 y portadora de banda gástrica desde hacía 4 años. Ingresa por vómitos de 2 años de evolución, que comienzan coincidiendo con el 5º mes de embarazo. Refiere pirosis y regurgitaciones frecuentes, disfagia progresiva para sólidos y líquidos, pérdida de peso (17 Kg en 18 meses) y vómitos en «posos de café». La exploración física pone de manifiesto una pequeña hernia umbilical reductible y mínima adenopatía laterocervical izquierda que se desplaza. En la analítica destaca discreta ferropenia. La panendoscopia oral muestra esofagitis péptica grado B/D de la clasificación de Los Ángeles, mínima hernia hiatal y cardias muy cerrado, con aspecto hipertónico sugerente de pseudoachalasia. Valorando el fundus gástrico en retrovisión se aprecia banda gástrica a nivel cardial (Figura 1).

Figura 1. Banda gástrica en retroversión endoscópica.
La manometría reveló terciarismo esofágico en sus dos tercios distales, muy ocasionalmente onda propulsiva y espontánea, no pudiendo realizar estudio de esfínter esofágico inferior por sensación de stop a 43 cm de fosa nasal y enroscarse permanentemente la sonda en esófago, siendo diagnosticada de acalasia incipiente (Figura 2). En el estudio esofagogastroduodenal (Figura 3) se observa dilatación esofágica, sin claro afilamiento distal, en tercio distal imágenes pseudodiverticulares en relación con pequeñas úlceras. Con el diagnóstico de pseudoachalasia secundaria a deslizamiento proximal de banda gástrica, la paciente es intervenida por vía laparoscópica con retirada de la misma, permaneciendo asintomática.

Figura 2. Manometría Esofágica (cuerpo esofágico).

Figura 3. Rx.EGD: Dilatación esofágica. Desplazamiento de banda
DISCUSIÓN
Ocasionalmente nos encontramos con pacientes en quienes el bandaje puede ocasionar dilatación esofágica y trastornos motores esofágicos. Los trabajos de Husemann y Demaria (9,10) ponen en evidencia una alta incidencia en clínica secundaria a reflujo, así como cuadros disfágicos y vómitos. Entre las complicaciones a medio y largo plazo de este tipo de técnica, se encuentra el deslizamiento de la banda, «Slippage», lo que sucede entre el 2.2 y 10% (1,2). Puede aparecer de modo agudo, requiriendo intervención inmediata, o de modo crónico, debiendo evaluar el desajuste de la banda o la retirada de la misma. Aparece en las primeras semanas tras su colocación, generalmente como consecuencia de no realizar cambios en los hábitos alimentarios por parte del paciente. El paciente suele presentar reflujo, intolerancia alimentaria, insuficiente pérdida de peso y vómitos. La dilatación esofágica no guarda relación con el diámetro del reservorio, pudiendo explicarse por una insuficiencia esfínteriana previa que condiciona pobre complacencia al faltar la sensación de saciedad. Motivo por el cual y dado que dicha complicación puede aparecer entre el 2.9 y el 15% de los casos (7, 8,11-13), sería recomendable la realización previa de estudios de motilidad. La valoración del paciente debe ser contemplada desde una vertiente multidisciplinar donde se incluyan no sólo cirujanos y endocrinólogos, sino también gastroenterólogos, neurólogos, nutricionistas, u otros en función de la patología asociada que pueda presentar el paciente. La banda gástrica constituye una técnica útil, pero es necesario conocer y reconocer sus particularidades para el diagnóstico y tratamiento de sus complicaciones.
BIBLIOGRAFÍA
- Chevarllier J-M, Zinzindohoué F, Blanche J-P, Berta J-L, Altman J-J, Cugnenc P. Complications after laparoscopic adjustable gastric banding for morbid obesity: Experience with 1.000 Patients over 7 years. Obes Surg 2004;14:407-14.
- Schauer P, Ikramuddin S. Cirugía laparoscópica para la obesidad mórbida. Clínicas Quirúrgicas de Norteamérica 2001;5:1181-1213.
- Eid I, Birch DW, Sharma Am, Sherman V, Karmali S. Complications associated with adjustable gastric banding morbid obesity: a surgeon´s guide. Can J Surg 2011:54 (1) 61-6.
- Pujol Ráfols Joan. Técnicas restrictivas en cirugía bariática. Cir Esp 2004;75(5):236-43.
- Lago Oliver J, Vázquez Amigo S, Sanz Sánchez M, Pérez Díaz ML, Mercader Cidoncha E, Vázquez Amigo JL, Turégano Fuentes F. La banda gástrica ajustable como tratamiento de la obesidad mórbida: ¿un mito o una realidad? Rev Esp Obes 2006;4(2):76-85.
- Lago Oliver J, Vázquez Amigo S, Sánchez García J, Pedraza Toledo G, et al. Adjustable gastric band as surgical for morbid abesity. Are worldwide results reproductibles in Spain? Cirugía Española Marzo 2013.
- Allen, Jeff W. Complicaciones de la banda gástrica laparoscópica. Med Clin N Am 2007,91(3):485-97.
- Martín Duce A, Díez del Val A. Cirugía de la obesidad mórbida. Ed Aran, 2007.
- Husemann B. Esophageal motility disorders after SAGB. 7th Congress of IFSO. Obes Surg 2002;12:466.
- DeMaría J, Sugermann J, Meador JG, Doty JM, Kellum JM, Wolfe L, et al. High failure rate after laparoscopic adjustable silicone gastric banding for treatment of morbid obesity. Ann Surg 2001;6:809-18.
- Vella M, Galloway D. Laparoscopic adjustable gastric banding for severe obesity. Obes Surg 2003;13.
- Favretti F, Cadieré GB, Segato G, Himpens J, De Luca M, Busetto L, De Marchi F, Foletto M, Caniato D,Lise M, Enzi G. Laparoscopic banding: Selection and technique in patients. Obes Surg 2002;12:385-90.
- Rubio Miguel A, Martínez C, Vidal O, Larrad A, Salas-Salvado J, Pujol J, Diez I, Moreno B. Documento de consenso sobre cirugía bariática. Rev Esp Obes 2004;4:223-49.
Hemorragia digestiva como debut de un tumor del estroma gastrointestinal (GIST)
Hemorragia digestiva como debut de un tumor del estroma gastrointestinal (GIST)
Berroa de la Rosa E, López Gómez JR (*), González Redondo G, Ruiz Rebollo MªL, Álvarez Quiñones Mª (**),
González Hernández JM
Servicio de Aparato Digestivo,Cirugía General y Aparato Digestivo (*) . Anatomía Patológica (**) .
Hospital Clínico Universitario de Valladolid.
RESUMEN
Dentro de los tumores malignos del intestino delgado se encuentran los sarcomas. El tumor del estroma gastrointestinal (GIST) es el más frecuente (83-86%). Generalmente presenta mutaciones en el protooncogen KIT (1). Muy ocasionalmente asocian mutaciones en otros genes, incluyendo a BRAF y SDHB (2). La cirugía es la opción terapéutica de elección en el GIST primario, y tiene como objeto resección con márgenes libres de enfermedad (3).
Presentamos el caso de un paciente ingresado por astenia y hematoquecia secundaria a un GIST, tratado quirúrgicamente con buena evolución.
Señor Director
La hemorragia digestiva (HDA) es una situación clínica grave que podría comprometer la vida del paciente. Una de sus manifestaciones es la hematoquecia. Dentro de sus causas se encuentran las angiodisplasias, los divertículos, las ulceraciones de diversas etiologías (isquémicas, infecciosas) y las neoplasias. Dentro de estos los GISTs, son una causa infrecuente.
Presentamos el caso de un varón de 80 años de edad que acudió a urgencias por un cuadro de astenia y hematoquecia, al que tras endoscopias digestivas alta y baja normales, se realiza cápsula endoscópica donde se encuentra una masa sangrante, cuyo estudio anatomopatológico confirmó la sospecha diagnóstica de GIST.
CASO CLÍNICO
Varón de 80 años sin antecedentes de interés que acude a Urgencias por astenia y hematoquecia. En la analítica se evidenció una anemia severa (hemoglobina 7 gr/dl). Se realizaron endoscopia digestiva alta y baja sin hallazgos por lo que se solicitó una cápsula endoscópica. En esta exploración se vio una masa en yeyuno con datos de sangrado reciente (A). El TAC abdominal mostró una masa hipervascularizada en intestino delgado, sin afectación hepática. El paciente fue intervenido quirúrgicamente. En la laparotomía se localizó la lesión, de unos 5 cm, en el borde antimesentérico de intestino delgado aproximadamente 1 metro distal al ángulo de Treitz (B, C). Se resecó la lesión y en el estudio histológico (D) se observó una proliferación celular homogénea con citoplasma eosinófilo y escasa actividad mitótica que era positiva para la tinción CD117 (c-KIT), compatible con el diagnóstico de tumor del estroma intestinal o GIST de riesgo intermedio-bajo. El paciente fue dado de alta y seguido de forma ambulatoria sin que se hayan encontrado datos de recidiva.
DISCUSIÓN
Los tumores del estroma gastrointestinal (GIST) derivan de las células intersticiales de Cajal y pueden surgir en cualquier lugar del tracto digestivo. Los derivados del intestino delgado son raros (20-30%) y generalmente tienen peor pronóstico (4). Más del 95% de los GIST son positivos para la tinción C-kit que raramente expresan otro tipo de tumores (5). El tratamiento es quirúrgico, generalmente resecciones segmentarias dado que son tumores encapsulados que ocasionalmente presentan invasión local, se diseminan principalmente de forma hematógena y casi nunca por vía linfática (6). Hay que tener cuidado con no romper la pseudocápsula y asegurarnos de que los bordes quirúrgicos estén libres de lesión (5). La recurrencia de estos tumores está habitualmente confinada a la cavidad abdominal por lo que la tomografía axial computarizada (TAC) es la modalidad de imagen ideal para su seguimiento (6). Tal cual recomiendan las guías clínicas, en el tumor de riesgo medio se debe realizar un TAC cada 4-6 meses durante los 3 primeros años de seguimiento para pasar después a realizarlo cada 6 meses hasta cumplir los 5 años, a partir de los cuales se harán anualmente hasta los 10 años (6).
En nuestro paciente en el TAC de seguimiento realizado no se evidenció progresión de su enfermedad.
BIBLIOGRAFÍA
- Pellisé M, Castells A: «Tumores del intestino delgado». En Montoro MA, García Pagán JC, Gastroenterología y Hepatología, 2ªed, Jarpyo Madrid 2012; 435-42.
- Jaramillo S, Ríos Moreno MJ, Hernández A, et al. Tumores del estroma gastrointestinal (GISTs): patrón de tinción tipo Golgi de CD 117 Y PDGFRA en el reconocimiento del estado mutacional. Revista Española Enfermedades Digestivas 2012; 104(3):128-33.
- Poveda A, Artigas V, Cervera J, et al. Guía de práctica clínica en los tumores estromales gastrointestinales (GIST): actualización 2010. Cirugía Española, 2011; June 89(1):11–2.
- Grover S, Ashley SW, Raut CP. Small intestine gastrointestinal stromal tumors Curr Opin Gastroenterol 2012 Mar; 28(2):113-23.
- Nishida T, Hirota S, Yanagisawa A, et al. Clinical practice guidelines for gastrointestinal stromal tumor (GIST) in Japan: English versión Int J Clin Oncol 2008 Oct;13(5):416-30.
- Cubas RF, Ballarino EA, Nieto FA Diaz MD. Local Resection of a Gastrointestinal Stromal Tumor of the Third Portion of the Duodenum Am Surg 2012 Jan;78(1):E22-3.z
Orientación diagnóstica y terapéutica del tumor fibrovascular esofágico
Orientación diagnóstica y terapéutica del tumor fibrovascular esofágico
Ovejero Gómez VJ*, Bermúdez García MV*, Pérez del Molino Castellanos A**, Gómez Lorenzo F*, Ingelmo Setien A*
* Servicio de Cirugía General y Aparato Digestivo. ** Servicio de Medicina Interna.
Hospital Sierrallana de Torrelavega. Cantabria.
Correspondencia:
Dr. Víctor J. Ovejero Gómez
Servicio de Cirugía General y Aparato Digestivo
Hospital Sierrallana de Torrelavega
Barrio de Ganzo, s/n (39300) Torrelavega. Cantabria
E-mail: vovejerohcas@msn.com
RESUMEN
Los pólipos fibrovasculares de esófago son tumoraciones benignas con afectación intraluminal localizadas preferentemente en el tercio proximal del órgano. Su síntoma más frecuente es la disfagia a sólidos después de un largo periodo silente. Su morfología pediculada con epitelio esofágico típico confiere cierta dificultad diagnóstica.
Su confirmación obliga a una escisión total del pólipo, incluso en pacientes asintomáticos, para evitar la mortalidad asociada a impactación glótica o complicaciones de su crecimiento.
La planificación del tratamiento exige la filiación de su localización, tamaño y densidad vascular del pedículo.
La TC y RMN representan los pilares del diagnóstico con vistas a esta planificación.
La endocopia digestiva apoyada en la ultrasonografía presenta un valor diagnóstico relativo pero puede ser útil para evaluar criterios endoscópicos de resección. La imposibilidad de este abordaje deriva en su tratamiento quirúrgico.
Presentamos el caso de una paciente tratada por un pólipo fibrovascular gigante de esófago como justificación para una revisión práctica de sus métodos diagnósticos y vías de abordaje terapéutico.
Palabras clave. Pólipo fibrovascular. Esófago. Disfagia. Diagnóstico. Tratamiento.
Key words. Fibrovascular polyp. Esophagus. Dysphagia. Diagnosis. Treatment.
Sr Director:
El pólipo fibrovascular es una lesión submucosa que representa el 1% de las tumoraciones benignas esofágicas (1) y la segunda más frecuente después del leiomioma. Tiene un origen mesodérmico con crecimiento a expensas de tejido fibroso y adiposo de vascularización variable, tapizado por un epitelio de revestimiento escamoso.
Presenta predilección masculina (3:1) y su mayor incidencia se encuentra entre la sexta y séptima década de la vida. Su degeneración maligna hacia carcinoma escamoso es poco probable (2,3).
Su escasa incidencia exige un alto nivel de sospecha. La dificultad diagnóstica y variabilidad terapéutica motivan una selección de los estudios y tratamientos actuales.
CASO CLÍNICO
Mujer de 46 años, sin antecedentes personales de interés, que refería disfagia no progresiva a sólidos de 4 meses de evolución con odinofagia ocasional, algún episodio de pirosis retroesternal y regurgitación tratados con omeprazol. En el examen físico presentaba buen estado nutricional sin hallazgos patológicos y todos los parámetros analíticos indicaron normalidad.
Una endoscopia digestiva alta visualizó un gran pólipo esofágico de unos dos centímetros de diámetro y diez de longitud que condicionaba una importante estenosis de la luz pero permitía el paso del endoscopio. La biopsia de la lesión se informó de epitelio plano esofágico sin signos de malignidad. Una TC torácica objetivó la tumoración esofágica endoluminal en contacto con la tráquea y extensión infracarinal, sin adenopatías mediastínicas ni alteraciones broncopulmonares.
Se decidió tratamiento quirúrgico, debido a la imposibilidad de resección endoscópica, mediante esofagotomía lateral por vía cervical, encontrando un enorme pólipo de consistencia blanda y elástica que se extendía al esófago torácico desde su base de implantación a nivel cricoideo. Efectuamos su resección y cierre primario de la esofagotomía. El estudio microscópico evidenció un estroma mesenquimal fibrovascular revestido por un epitelio escamoso con áreas ulceradas y diversas estructuras vasculares inmaduras rodeadas de actividad mitótica. El diagnóstico final fue de pólipo fibrovascular gigante de esófago. El postoperatorio transcurrió sin complicaciones demostrándose integridad del tránsito por esofagograma. La paciente se ha mantenido asintomática y sin evidencia de recurrencia en los cinco años posteriores.
DISCUSIÓN
Estos pólipos son lesiones no epiteliales, generalmente solitarias, cuya localización más frecuente es la hipofaringe y el esófago proximal sobre zonas de baja resistencia muscular como la dehiscencia de Killian y el triángulo de Laimer. Su crecimiento es lento desarrollando un pedículo largo por la escasa tensión mucosa local y el efecto peristáltico del órgano.
Puede permanecer asintomático mucho tiempo. Su síntoma de presentación suele ser la disfagia y la odinofagia aunque también es posible su regurgitación siendo visualizados en la cavidad bucal, o la obstrucción digestiva. Dicha disfagia y regurgitación han sido relacionadas con alteraciones en la motilidad esofágica y un déficit en su aclaramiento, secundarios al propio crecimiento del pólipo.
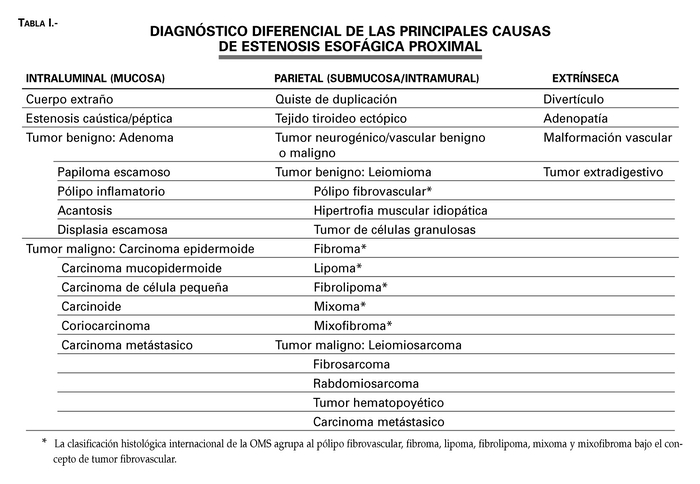
Su complicación más grave es la impactación glótica (4) derivando en asfixia con una mortalidad del 30%. La hematemesis o melenas por ulceración mucosa no resultan excepcionales. En su diagnóstico diferencial deben considerarse cuadros obstructivos intraluminales, lesiones parietales y compresiones extrínsecas (Tabla I). Si atendemos a su incidencia debería prestarse una especial consideración al cáncer esofágico, aunque dispongamos de una biopsia negativa para malignidad, y al leiomioma, aunque presente un crecimiento intramural generalmente en esófago medio y pueda ser supernumerario.

Tabla 1. Diagnóstico diferencial de las principales causas de estenosis esofágica proximal.
Su tratamiento de elección es la escisión completa del pólipo y su base de implantación, como forma de prevenir su recurrencia. La vía de abordaje puede ser transoral, transcervical o transtorácica y el acceso endoscópico o quirúrgico deberá planificarse mediante un estudio de imagen que defina la localización de la base, su tamaño y vascularización (4,5).
La TC y RMN representan los estudios de imagen ideales porque pueden determinar el origen, contenido del pólipo y su relación con tejidos adyacentes (6), lo cual resulta útil en pólipos muy vascularizados por su difícil control endoscópico del sangrado. Resulta característico en la RMN su alta intensidad de señal en T1 cuanto mayor es el contenido adiposo del pólipo (7). La esofagoscopia podría orientar sobre su localización, tamaño y estado de la superficie mucosa pero las posibilidades de que el pólipo pase desapercibido son altas (8) al estar tapizado de una mucosa normal y fácilmente desplazable por el endoscopio. Su correlación con la ecoendoscopia puede ayudar a establecer el flujo del tallo y contribuir al diagnóstico mediante PAAF (9). Los estudios baritados pueden mostrar un defecto de replección intraluminal y una dilatación hipertrófica proximal pero suele resultar difícil identificar su base implantación (10). Su utilidad resulta limitada si no se sospecha un transtorno motor asociado a la disfagia alta.
La vía de abordaje más común y segura es la esofagotomía cervical (11), al permitir un buen acceso hemostático a su base de implantación subcricoidea. Atendiendo a los criterios de tamaño, vascularización y localización, la resección endoscópica está indicada en pólipos alojados en orofaringe o hipofaringe e inferiores a dos centímetros de diámetro con pedículo fino que permita su ligadura, electrocoagulación o ablación con láser, sin excesivo riesgo de sangrado. En los pólipos mayores de ocho centímetros con pedículo muy vascularizado y grueso es obligada la extirpación quirúrgica. El seguimiento protocolizado de estas lesiones no está establecido por la rareza de su recidiva (12).
BIBLIOGRAFÍA
- Ginai AZ, Halfhide BC, Dees J, Zondervan PE, Klooswijk AI, Knegt PP. Giant esophageal polyp: a clinical and radiological entity with variable histology. Eur Radiol 1998; 8: 264-9.
- Marcial-Rojas RA. Epidermoid carcinoma in mucosa overlying a pedunculated lipoma of the esophagus. J Thorac Surg 1959; 34: 427–34.
- Drenth J, Wobbes T, Bonenkamp JJ, Nagengast FM. Recurrent esophageal fibrovascular polyps: case history and review of the literature. Dig Dis Sci 2002; 47: 2598-604.
- Parks JS, Bang BW, Shin J, Kwon KS, Kim HG, Shin YW, et al. A case of esophageal fibrovascular polyp that induced asphyxia during sleep. Clin Endosc 2014; 47: 101-3.
- Mishra PK, Goel N, Saluja SS, Durga G, Nag HH, Narag P. Management of giant fibrovascular polyp of esophagus. Am Surg 2012; 78: 538-40.
- Pallabazzer G, Santi S, Biagio S, D’Imporzano S. Difficult polypectomy-giant hypopharyngeal polyp: case report and literature review. World J Gastroenterol 2013; 19: 5936-9.
- Jang KM, Lee KS, Lee SJ, Kim EA, Kim TS, Han D, et al. The spectrum of benign esophageal lesions: imaging findings. Korean J Radiol 2002; 3: 199-210.
- Schuhmacher C, Becker K, Dittler HJ, Höfler H, Siewert JR, Stein HJ. Fibrovascular esophageal polyp as a diagnostic challenge. Dis Esophagus 2000; 13: 324-7.
- Lee SY, Chan WH, Sivanandan R, Lim DT, Wong WK. Recurrent giant fibrovascular polyp of the esophagus. World J Gastroenterol 2009; 15: 3697-700.
- Palanivelu C, Rangarajan M, John SJ, Annapoorni S, Senthilkumar S. A rare cause of intermittent dysphagia: giant fibrovascular polyp of the proximal esophagus. J Coll Physicians Surg Pak 2007; 17: 51-2.
- Vagli P, Solito B, Neri E, Faggioni L, Scandiffio R, Mantarro A, et al. Giant fibrovascular polyp of the esophagus-imaging techniques for proper treatment planning: report of two cases. Abdom Imaging 2012; 37: 512-8.
- Rice TW, Murthy SC. Surgical treatment of benign esophageal diseases. In: Sellke FW, Del Nido PJ, Swanson SJ, eds. Sabiston & Spencer Surgery of the Chest. 7th ed Philadelphia: Elsevier Saunders; 2005: 583-609.
La radiografía del cazador
La radiografía del cazador
Badia Aranda E, Sáez-Royuela F
Sección de Aparato Digestivo. Hospital Universitario de Burgos. Burgos, España.
Correspondencia:
Ester Badia Aranda
Secretaria Aparato Digestivo
Bloque B, planta 4
Hospital Universitario de Burgos
Islas Baleares, 3 • 09007 Burgos (España)
Correo electrónico: esterbadara@gmail.com
Móvil: +34 626350302
Imagen
Varón de 45 años que consultó tras un traumatismo. La radiografía simple de abdomen mostró varias imágenes redondeadas, de unos 2 mm de diámetro y densidad metálica (Figura 1). El paciente era cazador y consumidor frecuente de carne de caza. La exploración abdominal y la analítica fueron normales. Se consideró que había ingerido perdigones y se esperó su eliminación completa con las heces.

Figura 1. Radiografía simple de abdomen con varias imágenes redondeadas, de unos 2 mm de diámetro y densidad metálica.
En la radiografía realizada a los nueve meses de la primera, se observó que los perdigones habían quedado acumulados en el apéndice cecal (Figura 2), lo que se confirmó por ecografía. Ante los riesgos de apendicitis, perforación y absorción de plomo, se efectuó apendicectomía laparoscópica. En el estudio anatomopatológico del apéndice, se encontraron numerosos perdigones en su interior y hemorragia submucosa y vasos congestivos en la serosa. Los niveles de plomo en sangre fueron normales antes y tres meses después de la operación.

Figura 2. Radiografía de abdomen nueve meses después.