Peritonitis bacteriana secundaria en pacientes con cirrosis hepática
Manzanedo Bueno L1, Velasco Guardado A 2, Piñero Pérez C 2, Calderón Begazo R 2, Jamanca Poma Y 2,
Umaña Mejía J 2, Geijo Martínez F 2, Rodríguez Pérez A 2
1 Servicio de Medicina Interna. 2 Servicio de Aparato Digestivo. Hospital Universitario de Salamanca. Salamanca. España.
Correspondencia:
Pilar Marqués García
Antonio Velasco Guardado
Servicio de Aparato Digestivo
Hospital Universitario de Salamanca
Paseo San Vicente 55-182 • 37007 Salamanca
E-mail: antoniovelascog@usal.es
RESUMEN
La peritonitis bacteriana secundaria (PBS) es la infección del líquido ascítico secundaria a un foco infeccioso intra-abdominal. Se dispone en las últimas dos décadas de un número muy escaso de investigaciones clínicas sobre la PBS en la cirrosis hepática. Diferenciar de manera precoz entre peritonitis bacteriana espontánea y PBS es fundamental de cara al pronóstico del paciente. Ante la sospecha clínica de PBS y tras la punción del líquido ascítico, se debería realizar una TC urgente. En caso de datos de perforación (neumoperitoneo) en las pruebas de imagen, se debería indicar la laparoscopia o la cirugía urgente independientemente del estadio de Child. Si en el TC no hay datos de perforación se puede instaurar tratamiento antibiótico empírico de amplio espectro en espera de evolución, repitiendo la paracentesis diagnóstica cada 48 horas. Presentamos tres casos de pacientes cirróticos con diagnóstico de PBS resueltas de manera conservadora.
PALABRAS CLAVE: peritonitis bacteriana secundaria, cirrosis hepática.
INTRODUCCIÓN
La peritonitis bacteriana secundaria (PBS) es la infección del líquido ascítico secundaria a un foco infeccioso intra-abdominal. Aunque los datos disponibles son escasos, se estima que la PBS en los pacientes cirróticos representa el 10% de las peritonitis y presenta una mortalidad muy elevada (1-3).
A diferencia de lo que ocurre en la peritonitis bacteriana espontánea (PBE), en la PBS existe una pérdida de la integridad del tracto gastrointestinal. Puede ser secundaria a la perforación o a la inflamación aguda de órganos intra-abdominales, por ejemplo una víscera hueca perforada, infecciones de la pared abdominal anterior, procedimientos traumáticos como introducción externa de un material infectado o que posteriormente se infecta. La manifestación clínica más frecuente es el dolor agudo espontáneo, que suele ser difuso a la palpación abdominal y con rigidez de pared, sobre todo si se afecta el peritoneo parietal ricamente inervado. Puede ir acompañado o no de fiebre, taquicardia e hipotensión. Generalmente la analítica objetiva una intensa leucocitosis con neutrofilia y acidosis metabólica. La intensidad y características del dolor abdominal y de la evolución clínica dependerán del proceso causal subyacente y del grado de carga bacteriana en función del área del tubo digestivo comprometido. Es fundamental el diagnóstico precoz mediante pruebas radiológicas con el objetivo de localizar el origen de la contaminación peritoneal y valorar una intervención quirúrgica precoz. La antibioterapia de amplio espectro temprana disminuye la bacteriemia y la formación de abscesos, y previene la diseminación a distancia del proceso (4). El tratamiento antibiótico empírico deberá cubrir los microorganismos más frecuentemente implicados como Gram negativos (Escherichia coli, Klebsiella pneumoniae, Pseudomonas, Proteus o Enterobacter), Gram positivos (Enterococcus y Streptococus viridans) y anaerobios (Bacteroides fragilis, Clostridium sp, Peptostreptococci o Fusobacterium) (5,6). Hay que tener en cuenta que el tratamiento quirúrgico puede ir acompañado de un deterioro significativo en los pacientes cirróticos con estadio avanzado. Por lo tanto, el diagnóstico diferencial precoz y preciso entre PBS y PBE es crucial en estos pacientes.
Las recomendaciones para el diagnóstico diferencial es (7) realizar paracentesis diagnóstica en todos los pacientes cirróticos con ascitis. En base al resultado, podemos diferenciar entre:
- Peritonitis bacteriana espontánea. Recuento de PMN >250/mm3 (en pacientes con ascitis hemorrágica restar 1 PMN por cada 250 hematíes). La mayor sensibilidad para el diagnóstico de PBE se alcanza con un recuento de neutrófilos > 250/mm3, aunque la mayor especificidad es con un límite de 500 neutrofilos/mm3 en líquido ascítico).
- Bacterioascitis: cultivo positivo del líquido ascítico con recuento de PMN<250/mm3 en ausencia de infección local o sistémica.
- Peritonitis bacteriana secundaria. Se sospecha ante:
- Falta de respuesta al tratamiento antibiótico.
- Dos o más microorganismos aislados (fundamentalmente anaerobios y hongos).
- Al menos dos de los siguientes hallazgos (Criterios de Runyon (2)):
- Glucosa <50 mg/dL.
- Proteínas totales en líquido ascítico > 1 g/dL.
- Lactato deshidrogenasa > nivel normal en suero.
A continuación presentamos tres casos de pacientes cirróticos con diagnóstico de PBS resueltas de manera conservadora.
CASOS CLÍNICOS
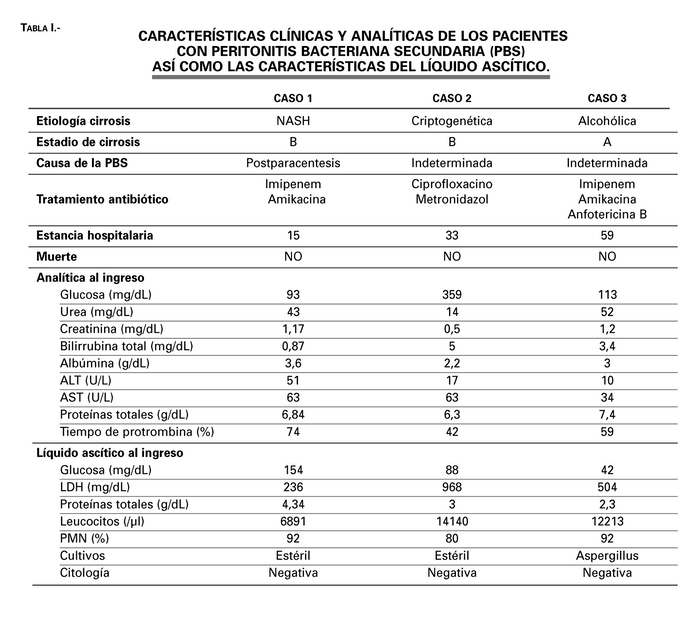
Los datos clínicos, analíticos y del líquido ascítico de cada uno de los casos se muestran en la Tabla I.

Tabla 1. Características clínicas y analíticas de los pacientes con peritonitis bacteriana secundaria (PBS) así como las características del líquido ascítico.
CASO 1
Mujer de 51 años con síndrome metabólico y cirrosis hepática secundaria a esteatohepatitis no alcohólica en estadio B de Child y con varios ingresos previos en nuestro servicio por descompensación edemoascítica. Ingresó de forma programada en el servicio de Digestivo para realización de paracentesis evacuadora por ascitis a tensión refractaria a tratamiento diurético. Se realizó una paracentesis diagnóstica y terapéutica extrayéndose 11 litros de líquido ascítico claro (Gluc 80 mg/dL, LDH 75 mg/dL, Leucocitos 52/µl, PMN 20%) y posteriormente se realizó reposición con albúmina intravenosa. A las 24 horas de la paracentensis la paciente comenzó con intenso dolor abdominal difuso no irradiado con signos de irritación peritoneal, presión arterial (PA) de 90/45 mmHg y frecuencia cardiaca (FC) de 110 latidos por minuto, sin fiebre. Se realizó una tomografía computerizada (TC) urgente en la que se observó abundante líquido libre intraperitoneal perihepático, periesplénico, entre asas y en pelvis, discreta distensión de asas de delgado, sin evidencia de neumoperitoneo, esplenomegalia y colelitiasis sin dilatación de vía biliar intrahepática. Vasos mesentéricos y portales permeables. Ante estos hallazgos y con la sospecha de complicación de la paracentesis previa se llevó a cabo una paracentesis diagnóstica (Tabla I). El cultivo del líquido ascítico fue negativo. Con el diagnóstico probable de peritonitis bacteriana secundaria a iatrogenia de la primera paracentesis se instauró tratamiento antibiótico con Imipenem y Amikacina, con muy buena respuesta clínica y normalización de parámetros analíticos del líquido ascítico, por lo que la paciente fue dada de alta tras 15 días de ingreso hospitalario.
CASO 2
Paciente mujer de 37 años alérgica a penicilinas en seguimiento en consultas de Digestivo, diagnosticada de cirrosis hepática criptogenética en estadio B de Child, que ingresó por cuadro de dolor abdominal difuso de 4 días de evolución con aumento progresivo del perímetro abdominal, vómitos, diarrea, ictericia y fiebre. En la exploración física destacó ictericia cutáneomucosa discreta, postración y afectación por intenso dolor abdominal difuso a la palpación superficial y profunda, ausencia de ruidos intestinales, sin signos de irritación peritoneal. Se realizó paracentesis diagnóstica en la que se obtuvo líquido ascítico con Gluc 88 mg/dL, LDH 986 mg/dL, Proteínas 3.0 g/dL, Leucocitos 14140/µ con 80% PMN. Ante la sospecha de peritonitis bacteriana se inició tratamiento antibiótico empírico con Ciprofloxacino y Vancomicina, y se realizó TC abdominal objetivándose hepatomegalia de contornos lobulados que tras la administración de contraste i.v. mostraba realce heterogéneo, con líquido libre intraperitoneal, perihepático, en gotieras paracólicas y en pelvis, esplenomegalia y circulación colateral. Ante la mala evolución clínica se realizó nuevo TC urgente que informó de la existencia de la pared del colon engrosada y mal definida sugerente de edema inespecífico, sin gas extraluminal ni colecciones que sugieran abscesos. Presentaba captación del peritoneo parietal en relación con peritonitis. Se cambió tratamiento antibiótico a ciprofloxacino más metronidazol con buena respuesta clínica y normalización de parámetros analíticos generales y del líquido ascítico. El cultivo del líquido ascítico, los coprocultivos y la toxina de Clostrium difficile fueron negativos. Se realizó colonoscopia más ileoscopia que objetivó engrosamiento de asas de ileon terminal, con resultado anatomopatológico de proceso crónico inflamatorio inespecífico. La paciente fue dada de alta hospitalaria pendiente de valoración de trasplante hepático ortotópico (THO) tras 33 días de ingreso hospitalario.
CASO 3
Paciente varón de 62 años con cirrosis hepática Child A, de origen enólico y síndrome hepatopulmonar. Ingresó en el servicio de Digestivo por episodio de descompensación hidrópica y fiebre. En la exploración física destacó dolor abdominal leve difuso a la palpación y semiología de ascitis. La paracentesis diagnóstica evidencia líquido ascítico con Gluc 42 mg/dL, LDH 504 mg/dL, Proteínas 2.3 g/dl, Leucocitos 12213/µ, 92% PMN. Se inició antibioterapia empírica con imipenem y se añadió Fluconazol i.v. al tratamiento ante cultivo positivo de orina para Cándida albicans.
Ante la persistencia de la clínica abdominal se realizó un TC en el que se observó ascitis perihepática, en flanco y pelvis, hígado de contornos irregulares con hipertrofia del lóbulo hepático izquierdo y atrofia del derecho, esplenomegalia, páncreas con pequeña calcificación sin significado patológico y colelitiasis múltiple. La Porta era calibre normal con circulación colateral en ligamento gástrico. No se objetivaron signos de perforación ni colecciones intraabdominales.
Posteriormente se realizaron paracentesis seriadas con resultados de líquido infectado a pesar de varios tratamientos empíricos, cultivos reiteradamente negativos y aumento de ADA, por lo que se solicitó Mantoux, Quantiferon en sangre periférica y líquido ascítico siendo todos ellos negativos. Se procedió a la realización de una laparoscopia exploradora para toma de biopsia peritoneal ante la sospecha de tuberculosis y se inició tratamiento antituberculoso. Tras la laparoscopia el paciente sufrió un deterioro significativo, con encefalopatía y aparición de nuevo de fiebre, junto con insuficiencia respiratoria aguda, motivo por el que precisó ingreso en UCI. Se aisló finalmente en el líquido ascítico una sola colonia de Aspergillus fumigatus. Presentó buena evolución tras añadirse al tratamiento con Imipenem y Amikacina, Anfotericina B. El paciente fue dado de alta tras 59 días de estancia hospitalaria.
DISCUSIÓN
Se dispone en las últimas dos décadas de un número muy escaso de investigaciones clínicas sobre la PBS en la cirrosis hepática. Diferenciar de manera precoz entre PBE y PBS es fundamental de cara al pronóstico del paciente.
El dolor abdominal ocasionado por la PBS es más intenso que en la PBE, debido en parte al mayor proceso inflamatorio local (mayor leucocitosis, LDH más alta y glucosa baja) (2, 8-10) y al mayor paso de bacterias. Debido a este hecho, la rentabilidad de la tinción del gram y el cultivo es mayor en la PBS que en la PBE (11). Otros datos que sugieren el diagnóstico de PBS son el cultivo polimicrobiano y la presencia de anaerobios u hongos (2, 8, 9, 11-13).
La rentabilidad diagnóstica de los criterios de Runyon varía de unos estudios a otros, con una sensibilidad entre el 66.6% y el 97% y la especificidad entre 56% y 89.6% (8-10), por lo que se han estudiado otros parámetros cuya elevación parece ser más específica en la PBS a perforación intestinal. En este sentido, Wu et al (9), utilizaron el antígeno carcinoembrionario (CEA) presente en enterocitos del colon, y la fosfatasa alcalina (FA) del tracto gastrointestinal para concluir que elevaciones de dichos parámetros en líquido ascítico probablemente no son resultado de cambios inflamatorios, sino más bien marcadores específicos para la perforación intestinal. Así pues, un líquido ascítico con FA > 240 U/l, ó CEA> 5 ng/ml, reflejará en el 80% de los casos peritonitis secundaria (14). Aunque no hay datos disponibles sobre la exactitud diagnóstica de esta combinación de criterios, el cumplimiento de cualquiera de los parámetros de Wu, junto con los criterios de Runyon, probablemente mejoren la sensibilidad y especificidad. El diagnóstico definitivo de peritonitis bacteriana secundaria se realiza mediante pruebas de imagen, cirugía o datos de la autopsia (2,8,9). El diagnóstico precoz de PBS permite instaurar tratamiento antibiótico empírico de amplio espectro y realizar una valoración por cirugía antes de que se instaure la respuesta inflamatoria sistémica que provoque el deterioro clínico del paciente.
En el estudio de Akriviadis y Runyon (8) la mortalidad de la PBS fue del 53% y fue independiente del estadio de Child. En 2010, Soriano y colaboradores (10), presentaron una investigación retrospectiva de 24 pacientes con PBS, realizada en dos hospitales de tercer nivel en España, durante un período observacional de siete años. La mortalidad de la PBS fue superior a la mortalidad de la PBE. En el estudio de Soriano, la mortalidad de la PBS fue del 66.6% frente al 26.4% de la PBE, independientemente de la etiología y/o la gravedad de la cirrosis. La mortalidad fue más baja (53.8%) en pacientes con PBS intervenidos quirúrgicamente frente a los que sólo recibieron tratamiento médico (81.8%) aunque estas diferencias no fueron estadísticamente significativas. Todos los pacientes con peritonitis bacteriana secundaria a perforación no operados murieron. La mortalidad fue menor en los pacientes intervenidos que en los que se realizó tratamiento conservador. Sin embargo, el tiempo entre la paracentesis y el diagnóstico de PBS fue superior en el grupo de pacientes fallecidos. Este dato junto con una presión arterial media menor en los pacientes fallecidos, hacen suponer, que el factor más importante para la supervivencia del paciente es la rápida instauración de un tratamiento eficaz, ya sea médico o quirúrgico, antes de que se instaure la respuesta inflamatoria sistémica o la sepsis.
En los casos presentados, llama la atención que ningún paciente falleció, probablemente debido a que ninguno de ellos presentaba datos de perforación en las pruebas de imagen. Ante la sospecha clínica de PBS y tras la punción del líquido ascítico, se debería realizar una TC urgente. En caso de datos de perforación (neumoperitoneo) en las pruebas de imagen, se debería indicar la laparoscopia o la cirugía urgente independientemente del estadio de Child. Si en el TC no hay datos de perforación se puede instaurar tratamiento antibiótico empírico de amplio espectro en espera de evolución, repitiendo la paracentesis diagnóstica cada 48 horas.
BIBLIOGRAFÍA
- Fernández J, Navasa M, Gómez J, Colmenero J, Vila J, Arroyo V, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35:140–8.
- Runyon BA, Hoefs JC. Ascitic fluid analysis in the differentiation of spontaneous bacterial peritonitis from gastrointestinal tract perforation into ascitic fluid. Hepatology 1984; 4:447–50.
- Castellote J, López C, Gornals J, Tremosa G, Fariña ER, Baliellas C. Rapid diagnosis of spontaneous bacterial peritonitis by use of reagent strips. Hepatology 2003; 37:893–6.
- Wong PF, Gilliam AD, Kumar S, Shenfine J, O’Dair GN, Leaper DJ. Antibiotic regimens for secondary peritonitis of gastrointestinal origin in adults. Cochrane Database Syst Rev 2005(2):CD004539.
- Solomkin JS, Mazuski JE, Bradley JS, Rodvold KA, Goldstein EJ, Baron EJ, et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Surg Infect (Larchmt) 2010 Feb;11(1):79-109.
- Wittmann DH, Schein M, Condon RE. Management of secondary peritonitis. Ann Surg 1996 Jul;224(1):10-8.
- Rimola A, Garcia-Tsao G, Navasa M, Piddock LJ, Planas R, Bernard B, et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000 Jan;32(1):142-53.
- Akriviadis EA, Runyon BA. Utility of an algorithm in differentiating spontaneous from secondary bacterial peritonitis. Gastroenterology 1990;98:127–33.
- Wu SS, Lin OS, Chen YY, Hwang KL, Soon MS, Keeffe EB. Ascitic fluid carcinoembryonic antigen and alkaline phosphatase levels for the differentiation of primary from secondary bacterial peritonitis with intestinal perforation. J Hepatol 2001 Feb;34(2):215-21.
- Soriano G, Castellote J, Alvarez C, Girbau A, Gordillo J, Baliellas C, et al. Secondary bacterial peritonitis in cirrhosis: a retrospective study of clinical and analytical characteristics, diagnosis and management. J Hepatol 2010 Jan;52(1):39-44.
- Runyon BA, Canawati HN, Akriviadis EA. Optimization of ascitic fluid culture technique. Gastroenterology 1988;95:1351–5.
- Runyon BA, Hoefs JC. Spontaneous vs. secondary bacterial peritonitis. Differentiation by response of ascitic fluid neutrophil count to antimicrobial therapy. Arch Int Med 1986;146:1563–5.
- Castellote J, Xiol X, Verdaguer R, Ribes J, Guardiola J, Giménez A, et al. Comparison of two ascitic fluid culture methods in cirrhotic patients with spontaneous bacterial peritonitis. Am J Gastroenterol 1990;85:1605–8.
- Fernández J, Navasa M, Planas R, Montoliu S, Monfort D, Soriano G, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Gastroenterology 2007;133:818–24.
