Abril 2015
Carta del presidente: Debemos indexar la revista
Carta del presidente: Debemos indexar la revista
Queridos socios después de diez años en la junta directiva desempeño el cargo de presidente de la Asociación Castellana de Aparato Digestivo. A lo largo de estos años he visto cómo un gran número de compañeros han formado parte de esta junta y desempeñado de forma completamente desinteresada y responsable diferentes cargos en la misma o han asumido la organización de la reunión anual. Esto ha supuesto siempre tiempo y esfuerzo y su recompensa únicamente comprobar que las cosas van saliendo, las reuniones se van celebrando y este año se celebrará la 37ª reunión en Salamanca. Otros presidentes mucho mejor preparados y con más experiencia desempeñaron la función de la que ahora me encargo yo, y con su dirección, el trabajo de la junta y el apoyo de los socios lograron la continuidad de la asociación en circunstancias diferentes y últimamente adversas. No voy a hablaros del pasado sin embrago sino del futuro.
La ACAD cuenta con una serie de aspectos de los que debe aprovecharse y sacar partido. Uno es que su fundamento es la especialidad de Aparato digestivo, toda ella. Constituye por tanto un foro en el que pueden tratarse una enormidad de aspectos médicos desde la mucosectomía endoscópica a la pancreatitis autoinmune o la hepatotoxicidad por fármacos y esto es sin duda de gran utilidad para una actualización constante y para la formación de nuestros médicos residentes. En este sentido entendemos que implicar a los residentes en la asociación es fundamental y así tenemos que procurar aunar sus necesidades y preferencias con la experiencia de los más veteranos. Otro aspecto es la cercanía geográfica y tradicionalmente afectuosa que existe entre los socios y hospitales, que permite una colaboración más sencilla entre todos y facilita la participación de los más jóvenes. Y por otro lado, el gran número de provincias y hospitales que conforman la ACAD y la enriquecen y facilita realizar proyectos y estudios colaborativos y multicéntricos.
Durante el último año hemos desarrollado la nueva página web. Ha sido fruto del trabajo intenso y del entusiasmo de los miembros de la junta directiva dirigidos por el presidente saliente, José Luis Olcoz. El objetivo que indudablemente debemos proponernos a continuación es la indexación de la revista. Actualmente los trabajos publicados en la Revista de la ACAD puntúan en baremos de concursos y oposiciones de diferentes organismos pero somos conscientes de que no es suficiente y que hay que hacer justicia al esfuerzo de los autores y de su redactor. Se ha formado un comité editorial y con la web hemos facilitado el envío de los trabajos al redactor. Os animo a que además de visitar la página web utilicéis esta herramienta para que la indexación de la revista esté cada vez más cerca y podamos dar ese salto.
Termino manifestándoos dos cosas: mi disponibilidad absoluta a los socios y mi reconocimiento y agradecimiento a los miembros de la junta que con su apoyo y trabajo impagables hacen que me enfrente a mis obligaciones con optimismo.
Dr. Luis Fernández Salazar
Presidente de la ACAD
Preocupaciones de los pacientes con enfermedad inflamatoria intestinal. Correlación con la calidad de vida. Resultados preliminares.
Preocupaciones de los pacientes con enfermedad inflamatoria intestinal. Correlación con la calidad de vida. Resultados preliminares.
Berroa E (*), Fernández-Salazar L (*), Rodríguez McCullough N (&), Garrote Adrados JA (#)
Servicio de Aparato Digestivo del Hospital Clínico Universitario de Valladolid (*).
Servicio de Cardiología, Papwoth Hospital, Cambridge, Reino Unido (&).
Servicio de Análisis Clínicos del Hospital Universitario Río Hortega de Valladolid (#)
Trabajo Enviado: 31/12/2014
Aceptado para su publicación: 7/03/2015
Correspondencia:
Luis Fernández Salazar
luisfernsal@gmail.com
RESUMEN
Introducción. El cuestionario RFIPC mide las preocupaciones de los pacientes con EII. La calidad de vida de los pacientes es un aspecto cada vez más tenido en cuenta por los médicos que atienden a estos pacientes.
Objetivos. Nuestro objetivo es describir qué preocupa a los pacientes con EII y relacionar estas preocupaciones con aspectos de la historia clínica de los pacientes y con su calidad de vida.
Métodos. Hemos entrevistado a 61 pacientes con EII (39 con EC y 22 con CU). Durante la entrevista el paciente completó los cuestionarios RFIPC e IBDQ32. Los datos clínicos se obtuvieron de la historia clínica de cada paciente. Los valores clínicos y analíticos de actividad se obtuvieron en la última consulta médica a la que acudió el paciente. Se han empleado media, desviación estándar y porcentajes para describir a los pacientes. Se hizo un análisis factorial de las respuestas a los 25 ítems del RFIPC obteniendo 6 factores. Se ha comparado la puntuación total del RFIPC en función de las diferentes variables clínicas Para la comparación de medias se ha empleado la prueba t de student. Se ha estudiado la correlación entre el RFIPC y sus 6 factores con el IBDQ32 y sus 4 dimensiones. Para las pruebas de correlación se ha utilizado el test de Spearman.
Resultados. La puntuación media del RFIPC del total de pacientes fue 47,1±19,8. Los ítems con mayor puntuación fueron: la posibilidad de tener que llevar una bolsa de ileostomía o colostomía, el riesgo de efectos adversos de las medicinas y el riesgo de tener un cáncer. La puntuación total fue mayor en mujeres que en hombres (52,6±18,5 vs 41,9±19,0, p 0,026). No se encontró mayor puntuación del RFIPC en relación con la edad, tiempo de evolución, tratamiento con corticoides, tratamiento con INM, antiTNF, cirugía previa o ingresos previos. Entre los pacientes con EC se mantiene la mayor preocupación entre mujeres (52,1±21,9 vs 35,8±17,9, p 0,055), y además en pacientes de menos de 40 años (54,4±14,9 vs 39,9±21,2, p 0,047), y con comportamiento inflamatorio (B1 50,9±17,7vs B2 41,2±29,8 vs B3 24,8±6,2, p 0,011). RFIPC e IBDQ32 presentaron correlación entre los pacientes con EC. Las correlaciones fueron más marcadas fueron con el factor “consecuencias de la enfermedad” del RFIPC y con el aspecto emocional del IBDQ32.
Conclusiones. La puntuación total de los pacientes es relativamente alta. Las preocupaciones medidas por cuestionario RFIPC no se relacionan con la historia clínica del paciente o con la actividad de la enfermedad pero en la EC la preocupación es mayor entre mujeres, en pacientes de menos de 40 años, formas inflamatorias, y además está claramente relacionada con la calidad de vida del paciente principalmente con la esfera emocional.
INTRODUCCIÓN
La enfermedad inflamatoria intestinal (EII) tiene una prevalencia alta en nuestro medio (1) y provoca síntomas que comprometen la calidad de vida de los pacientes. Su tratamiento puede requerir el ingreso de los pacientes y se basa en fármacos con escasos efectos adversos como la mesalazina y otros que no están libres de riesgos como los corticoides, fármacos inmunosupresores tiopurínicos (azatioprina o mercaptopurina), metotrexate, fármacos biológicos (infliximab, adalimumab o golimumab) o bien requerir tratamiento quirúrgico (2-5).
La calidad de vida relacionada con la salud es un aspecto que cada vez está recibiendo mayor atención por parte de los clínicos. Para medirla se han desarrollado índices o escalas (6). La calidad de vida no depende solo de los síntomas y actividad de la enfermedad o su tratamiento médico o quirúrgico. En la EII los aspectos psicosociales y emocionales influyen tanto o más (7, 8). Disponemos de una escala de calidad de vida específica de EII, el IBDQ32, traducido al español y validado (9).
Un aspecto aún poco explorado que probablemente está muy relacionado con la calidad de vida de los pacientes son sus preocupaciones. Estas pueden no coincidir con las que tiene el médico (10), pueden relacionarse directamente con la enfermedad o con otros factores sociales, familiares o laborales. El cuestionario RFIPC (Rating Form of IBD Patient Concerns) consta de 25 ítems y con él se mide la intensidad de la preocupación que tienen los pacientes con EII (8, 11). El RFIPC ha sido traducido y validado en numerosos países europeos (12-14).
OBJETIVO
Estudio descriptivo transversal de las preocupaciones que tienen los pacientes con EII según el cuestionario RFIPC traducido al español. Estudio de la relación que pueda existir entre las preocupaciones y la historia clínica y la calidad de vida de los pacientes medida con el IBDQ32.
MATERIAL Y MÉTODOS
Solicitamos la participación en el estudio a 70 pacientes con EII de los que 61 aceptaron (39 con enfermedad de Crohn y 22 con colitis ulcerosa). El estudio consistía en una entrevista a la que también acudía un familiar. En esta entrevista el paciente contestaba por si solo la traducción del cuestionario RFIPC y el IBDQ32. Solo se incluyeron 4 pacientes ingresados.
El cuestionario RFIPC consta de 25 preguntas o ítems. El encabezamiento es común a todos ellos: “Por la enfermedad que padece cómo está usted de preocupado de 0 a 100 por:”. El paciente responde con una marca sobre una escala analógica visual horizontal que puntúa de 0 a 100 de 10 en 10. La traducción del índice RFIPC se llevó a cabo por un conjunto de tres médicos, uno de ellos (NRM) con doble nacionalidad británica y española con residencia y trabajo en el Reino Unido y los otros dos españoles (JAGA y LFS) con residencia y trabajo en España.
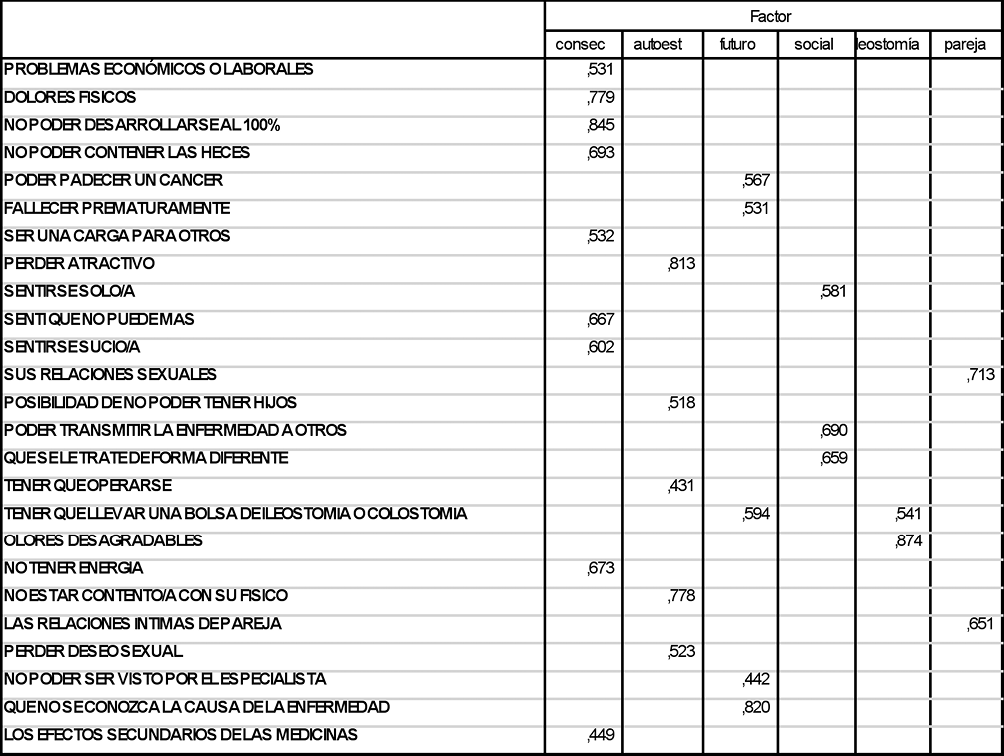
Con las respuestas de los pacientes se realizó un análisis factorial con el método de máxima verosimilitud y rotación varimax para agrupar y resumir los 25 ítems obteniendo 6 dimensiones o factores que hemos denominado: “Consecuencias de la enfermedad”, “Autoestima”, “Preocupaciones por el futuro”, “Aspecto social”, “Preocupaciones por la ileostomía”, “Preocupación por la relación de pareja” (Tabla I). En general cada ítem se incorporó al factor en el que mayor peso ejercía, si el peso era inferior a 0,40 el ítem o pregunta no se incorporaba a ningún factor. De esta forma cada paciente cuenta con una puntuación total, una puntuación de cada uno de los 6 factores y una puntuación de cada uno de los 25 ítems.
Análisis factorial que permite agrupar los 25 items del RFIPC en 6 factores. Matriz de factores arotados.

El IBDQ32 es un cuestionario ya traducido y validado al español que incluye 32 ítems agrupados en cuatro dominios: Manifestaciones intestinales, manifestaciones sistémicas, aspectos sociales y emocionales.
Los datos clínicos de la historia clínica del paciente (tiempo de evolución, extensión y comportamiento, tratamiento con corticoides, con inmunosupresores, con antiTNF, antecedentes quirúrgicos) se obtuvieron en la última consulta a la que acudió el paciente en la que se le propuso la participación en el estudio donde además se recogió el índice HBI para la EC y el índice de Mayo (sin valoración endoscópica) para la CU y el valor de la PCR en los 3 meses previos a la consulta.
Las variables se han expresado con medias y desviación estándar y porcentajes. Las medias de las puntuaciones se han comparado con la prueba de t de student. La correlación entre las puntuaciones se investigó con el test de Spearman. La consistencia interna del cuestionario se comprobó con un valor alfa de Cronbach de 0,939.

RESULTADOS
La puntuación media del RFIPC del total de pacientes fue 47,1±19,8. La Figura 1 muestra los valores medios de los 25 ítems del RFIPC del total de pacientes, de los pacientes con EC y de los pacientes con CU. En general los pacientes con CU tienen puntuaciones más altas que los pacientes con EC. Los tres ítems que más preocupaban a la totalidad de los pacientes fueron: la posibilidad de tener que llevar una bolsa de ileostomía o colostomía que es la mayor preocupación de los pacientes con CU, el riesgo de efectos adversos de las medicinas que es la mayor preocupación de los pacientes con EC y el riesgo de tener un cáncer que fue la segunda preocupación más intensa en pacientes con CU. Otras preocupaciones relacionadas de forma más indirecta con la EII fueron: la preocupación por no ser visto por su médico, el desconocimiento de la causa de la enfermedad y el poder ser una carga para otros. La importancia de estos tres ítems refleja la relevancia de los aspectos no claramente médicos sino asistenciales o familiares que tiene la EII.
Puntuación de RFIPC en 61 pacientes con eii según edad, sexo, tipo de enfermedad y tratamientos.

Tabla II
Puntuación de RFIPC en 39 pacientes con enfermedad de Crohn y 22 pacientes con CU.

Tabla III
Las Tablas II y III muestran las diferencias de la puntuación total del RFIPC según las distintas variables clínicas del total de pacientes, de los pacientes con EC y de los pacientes con CU. En el total de pacientes tan solo hay diferencias estadísticamente significativas en relación al sexo siendo mayor la puntuación de las mujeres que la de los hombres (52,6±18,5 vs 41,9±19,0, p 0,026). Entre los pacientes con EC se mantiene la mayor preocupación de las mujeres (52,1±21,9 vs 35,8±17,9, p 0,055), y se comprueba una mayor preocupación en pacientes de menos de 40 años (54,4±14,9 vs 39,9±21,2, p 0,047), y en pacientes con comportamiento inflamatorio de la EC (B1 50,9±17,7vs B2 41,2±29,8 vs B3 24,8±6,2, p 0,011).
La Tabla IV muestra las correlaciones entre la suma total y los 6 factores del RFIPC con el IBDQ32 y sus 4 dominios del total de pacientes. Se aprecia una correlación entre algunos de los factores del RFIPC y dominios de IBDQ32. El factor “Consecuencias de la enfermedad” del RFIPC es el que muestra una correlación más clara con los diferentes dominios del IBDQ32. La Tabla V muestra la correlación entre el RFIPC y los 4 dominios del IBDQ32 de pacientes con EC y con CU. Sólo en los pacientes con EC existe correlación entre RFIPC e IBDQ32 siendo el dominio de síntomas intestinales del IBDQ32 el que presenta una correlación más clara con el RFIPC (r 0,547 p 0,001).
DISCUSIÓN
La puntuación media total de nuestros pacientes es superior a la descrita en otros estudios europeos o americanos (8, 12, 13). El valor medio total que encontramos es superior al de Italia e inferior al de Portugal según un estudio que recoge datos de 2002 pacientes entre 1991 y 1993 procedentes de Austria, Francia, Israel, Italia, Portugal, Suecia, Canadá y EEUU (14). En este estudio se describe un gradiente de intensidad de preocupación de norte a sur en Europa, siendo mayor la preocupación de los pacientes en el sur que en el norte (14). Con nuestros resultados se podría plantear si no existe un gradiente que aumente en sentido este-oeste dentro de Europa.
Correlación entre los factores del RFIPC y el RFIPC total y los cuatro dominios de IBDQ32 e IBDQ total del total de pacientes (Spearman, R y P)…

Tabla IV
Correlación entre la puntuación de RFIPC y la puntuación de IBDQ32 en los 39 pacientes con enfermedad de Crohn y los 22 pacientes con CU…

Tabla V
La puntuación total del RFIPC representa en realidad el promedio de un conjunto numeroso y heterogéneo de preocupaciones. Para disminuir esta heterogeneidad y facilitar las comparaciones se ha tratado de agrupar los ítems con análisis factoriales creando dimensiones o factores que permitan resumir la información, como hemos hecho también nosotros, pero estos análisis difieren en cada estudio con las diferentes respuestas a las preguntas y la agrupación de los ítems no es la misma lo que impide las comparaciones (15). Una opción sería comparar ítem por ítem.
Los ítems que más puntúan en otros trabajos previos al nuestro son la necesidad de cirugía, la necesidad de una bolsa de ileostomía, un fallecimiento prematuro, perder el control esfinteriano, el nivel de energía, o el efecto adversos de las medicinas (8, 12-14, 16). En nuestros pacientes las preocupaciones con mayor puntuación también fueron la necesidad de una bolsa de ileostomía, los efectos adversos de las medicinas y desarrollar un cáncer. La cuarta preocupación más importante es la debida a la falta de energía o cansancio. Este es un aspecto que también está recibiendo cada vez más atención por parte de los especialistas en EII y está relacionado con factores como la actividad de la enfermedad, la anemia o ferropenia, los trastornos del sueño, las preocupaciones del paciente y su calidad de vida (17).
A la hora de interpretar los resultados del estudio tenemos que tener en cuenta que la mayoría de los pacientes incluidos son pacientes en una situación clínica estable, con escasa actividad de su enfermedad y que acuden a la consulta a revisiones programadas. Es evidente, y así se ha demostrado, que las preocupaciones de los pacientes ingresados son diferentes y en general más intensas (8). En este sentido nuestro grupo de pacientes sería equiparable al de un estudio prospectivo noruego (13). Nos llama la atención que los antecedentes de ingreso hospitalario o de cirugía, el uso de determinadas medicinas, y los índices de actividad no se asocian a mayor puntuación total del RFIPC. En el trabajo noruego antes mencionado los datos clínicos o la historia pasada tampoco se asociaba a mayor preocupación, pero sí lo hacía la presencia de síntomas (13). La relación entre preocupación y síntomas también ha sido establecida en un estudio canadiense (16) en el que además, una vez controlada la variable “síntomas” se encuentra una relación estrecha entre preocupaciones y calidad de vida. En nuestros pacientes sí se encuentra mayor preocupación entre pacientes con EC con comportamiento inflamatorio comparados con los que tienen forma estenosante y fistulizante probablemente por estar más sintomáticos aunque no hemos encontrado relación con datos de actividad.
Se ha descrito que las preocupaciones se correlacionan más con la calidad de vida que con los índices de actividad (15, 16). Comprobamos que los dominios del IBDQ32 más claramente correlacionado con la puntuación total del RFIPC son el emocional para el total de los pacientes, y el dominio de síntomas intestinales en los pacientes con EC. No hemos incluido en este trabajo test que valoren la ansiedad o la depresión u otros test de calidad de vida relacionada con la salud no específicos de la EII que probablemente contribuirían a clarificar estos hallazgos.
El trabajo es un estudio preliminar con un número aún reducido de pacientes y además aunque el cuestionario ha demostrado buena consistencia interna tenemos pendiente aún su validación.
Aunque las preocupaciones de los pacientes con EII pueden no coincidir con las de sus médicos (10), es evidente que hay preocupaciones comunes a pacientes y médicos como son los efectos adversos de las medicinas, la necesidad de cirugía, y por supuesto el riesgo de cáncer. La asociación con la calidad de vida es de correlación y no es una relación de causa-efecto. No podemos saber si los pacientes están preocupados por tener peor calidad de vida, o si tienen peor calidad de vida por estar preocupados, pero en cualquier caso probablemente se pueda intervenir en el grado de preocupación mediante una información más específica o dirigida a los aspectos de más importancia, lo que quizá podría mejorar la calidad de vida de los pacientes.
BIBLIOGRAFÍA
1. Lucendo AJ, Hervias D, Roncero O, Lorente R, Bouhmidi A, Angueira T, et al. Epidemiology and temporal trends (2000-2012) of inflammatory bowel disease in adult patients in a central region of Spain. European Journal of Gastroenterology & Hepatology 2014 Dec;26(12):1399-407. PubMed PMID: 25341061. Epub 2014/10/24. eng.
2. Van Assche G, Dignass A, Panes J, Beaugerie L, Karagiannis J, Allez M, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Definitions and diagnosis. Journal of Crohn’s & Colitis 2010 Feb;4(1):7-27. PubMed PMID: 21122488. Epub 2010/12/03. eng.
3. Dignass A, Eliakim R, Magro F, Maaser C, Chowers Y, Geboes K, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 1: definitions and diagnosis. Journal of Crohn’s & Colitis 2012 Dec;6(10):965-90. PubMed PMID: 23040452. Epub 2012/10/09. eng.
4. Dignass A, Van Assche G, Lindsay JO, Lemann M, Soderholm J, Colombel JF, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. Journal of Crohn’s & Colitis 2010 Feb;4(1):28-62. PubMed PMID: 21122489. Epub 2010/12/03. eng.
5. Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, Allez M, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. Journal of Crohn’s & Colitis 2012 Dec;6(10):991-1030. PubMed PMID: 23040451. Epub 2012/10/09. eng.
6. Vilagut G, Valderas JM, Ferrer M, Garin O, Lopez-Garcia E, Alonso J. [Interpretation of SF-36 and SF-12 questionnaires in Spain: physical and mental components]. Medicina Clínica. 2008 May 24;130(19):726-35. PubMed PMID: 18570798. Epub 2008/06/24. Interpretacion de los cuestionarios de salud SF-36 y SF-12 en Espana: componentes fisico y mental. spa.
7. Iglesias-Rey M, Barreiro-de Acosta M, Caamano-Isorna F, Rodríguez IV, Ferreiro R, Lindkvist B, et al. Psychological factors are associated with changes in the health-related quality of life in inflammatory bowel disease. Inflammatory Bowel Diseases 2014 Jan;20(1):92-102. PubMed PMID: 24193152. Epub 2013/11/07. eng.
8. Drossman DA, Patrick DL, Mitchell CM, Zagami EA, Appelbaum MI. Health-related quality of life in inflammatory bowel disease. Functional status and patient worries and concerns. Digestive Diseases and Sciences 1989 Sep;34(9):1379-86. PubMed PMID: 2766905. Epub 1989/09/01. eng.
9. López-Vivancos J, Casellas F, Badia X, Vilaseca J, Malagelada JR. Validation of the spanish version of the inflammatory bowel disease questionnaire on ulcerative colitis and Crohn’s disease. Digestion 1999;60(3):274-80. PubMed PMID: 10343142. Epub 1999/05/27. eng.
10. Cervesi C, Battistutta S, Martelossi S, Ronfani L, Ventura A. Health priorities in adolescents with inflammatory bowel disease: physicians’ versus patients’ perspectives. Journal of Pediatric Gastroenterology and Nutrition 2013 Jul;57(1):39-42. PubMed PMID: 23403446. Epub 2013/02/14. eng.
11. Drossman DA, Leserman J, Li ZM, Mitchell CM, Zagami EA, Patrick DL. The rating form of IBD patient concerns: a new measure of health status. Psychosomatic Medicine 1991 Nov-Dec;53(6):701-12. PubMed PMID: 1758953. Epub 1991/11/01. eng.
12. Stjernman H, Tysk C, Almer S, Strom M, Hjortswang H. Worries and concerns in a large unselected cohort of patients with Crohn’s disease. Scandinavian Journal of Gastroenterology 2010 Jun;45(6):696-706. PubMed PMID: 20334474. Epub 2010/03/26. eng.
13. Jelsness-Jorgensen LP, Moum B, Bernklev T. Worries and Concerns among Inflammatory Bowel Disease Patients Followed Prospectively over One Year. Gastroenterology Research and Practice 2011;2011:492034. PubMed PMID: 21912537. Pubmed Central PMCID: PMC3168269. Epub 2011/09/14. eng.
14. Levenstein S, Li Z, Almer S, Barbosa A, Marquis P, Moser G, et al. Cross-cultural variation in disease-related concerns among patients with inflammatory bowel disease. The American Journal of Gastroenterology 2001 Jun;96(6):1822-30. PubMed PMID: 11419836. Epub 2001/06/23. eng.
15. Hjortswang H, Almer S, Strom M. The network: a strategy to describe the relationship between quality of life and disease activity. The case of inflammatory bowel disease. European Journal of Gastroenterology & Hepatology 1999 Oct;11(10):1099-104. PubMed PMID: 10524638. Epub 1999/10/19. eng.
16. de Rooy EC, Toner BB, Maunder RG, Greenberg GR, Baron D, Steinhart AH, et al. Concerns of patients with inflammatory bowel disease: results from a clinical population. The American Journal of Gastroenterology 2001 Jun;96(6):1816-21. PubMed PMID: 11419835. Epub 2001/06/23. eng.
17. Jelsness-Jorgensen LP, Bernklev T, Henriksen M, Torp R, Moum B. Chronic fatigue is associated with increased disease-related worries and concerns in inflammatory bowel disease. World Journal of Gastroenterology: WJG 2012 Feb 7;18(5):445-52. PubMed PMID: 22346250. Pubmed Central PMCID: PMC3270510. Epub 2012/02/22. eng.
Malrotación intestinal en adultos
Malrotación intestinal en adultos
Vila y Blanco J M, Said Nabhan*
Jefe de Servicio*. Servicio de Cirugía General y Digestiva. Hospital Virgen de la Luz. Cuenca.
Trabajo Enviado: 28/11/2014
Aceptado para su publicación: 30/03/2015
Correspondencia:
Julio Miguel Vila y Blanco
C/ Pocito de las Nieves nº 4, 2ºA
Las Rozas de Madrid
28230- Madrid
E-mail: jmvilab@movistar.es
RESUMEN
Introducción. La malrotación intestinal congénita suele presentarse como obstrucción intestinal aguda en neonatos y lactantes. Ocasionalmente no se manifiesta hasta la edad adulta. El objetivo del trabajo es exponer casos de malrotación intestinal diagnosticados en adultos en nuestro Servicio.
Pacientes y métodos. Estudio clínico descriptivo y retrospectivo durante un periodo de 8 años (2006-2014) de los adultos sintomáticos diagnosticados de malrotación intestinal.
Resultados. Diagnóstico de malrotación intestinal, 8 hombres y 3 mujeres, edad media 51, DE 22, rango 22-79. Se apreciaron 2 anomalías anatómicas acompañantes (alteraciones vasculares y poliesplenia). El 82% habían presentado cuadros abdominales recurrentes, con ingresos previos hasta el diagnóstico final. Las intervenciones por abdomen agudo fueron: obstrucción intestinal (3/11= 27%), apendicitis en fosa ilíaca izquierda (2/11= 18%) e isquemia intestinal (1/11= 9%). Otros 5 pacientes (45%) se intervinieron de forma programada y un paciente no precisó Cirugía. La TAC abdominal urgente fue la prueba diagnóstica principal (concluyente en el 86%) seguida del tránsito intestinal baritado en pacientes sin abdomen agudo. En el seguimiento se apreciaron episodios de recurrencia menor en el 55% de los pacientes, principalmente dolor abdominal recurrente que requirieron ingreso pero no más intervenciones quirúrgicas. 5 pacientes (45%) hacen vida normal sin recurrencias. No hubo mortalidad derivada de las intervenciones quirúrgicas.
Conclusiones. La malrotación intestinal es un cuadro clínico raro en adultos, con clínica abdominal recurrente. La sospecha clínica es fundamental para el diagnóstico, confirmado o realizado mediante la radiología (tránsito intestinal programado y TAC programado o urgente) y su tratamiento es generalmente quirúrgico.
Palabras clave. Malrotación; adultos; radiología; cirugía.
ABSTRACT
Introduction. Congenital Intestinal malrotation is usually presented as acute intestinal obstruction in neonates and infants. Occasionally it does not manifest until adulthood. The aim of this work is to expose cases of intestinal malrotation in adults diagnosed in our department.
Patients and methods. Descriptive and retrospective clinical study over a period of 8 years (2006-2014) of symptomatic adults diagnosed with intestinal malrotation.
Result. They were diagnosed with intestinal malrotation 8 men and 3 women, mean age 51, SD 22, range 22-79. Two accompanying anatomical abnormalities (vascular alterations and polysplenia) were noted. 82% of the patients had recurrent abdominal symptoms, with previous admissions to the final diagnosis. Acute abdominal interventions were: intestinal obstruction (3/11 = 27%), appendicitis in left iliac fossa (2/11 = 18%) and intestinal ischemia (1/11 = 9%). Another 5 patients (45%) were operated on a scheduled basis and one patient did not require surgery. A CT scan was urgent (conclusive in 86%) followed by the main diagnostic test barium in patients without acute abdomen. At follow some kind of lower recurrence were noted in 55% of patients, mostly recurrent abdominal pain requiring admission but not more surgeries. 5 patients (45%) make normal life without recurrences. There was no mortality of surgical interventions.
Conclusion. Intestinal malrotation is a rare clinical condition in adults with recurrent abdominal symptoms. Clinical suspicion is essential for diagnosis, confirmed by radiology or performed (programmed intestinal transit and scheduled or urgent TAC) and its treatment is usually surgical.
Keywords. Malrotation; adults; radiology; surgery.
INTRODUCCIÓN
Las malformaciones intestinales constituyen una patología poco habitual y suelen clasificarse por su embriogénesis y por las repercusiones clínicas que ocasionan. Las más frecuentes son las malrotaciones y atresias (75-90%) y suelen producir una obstrucción duodenal aguda en neonatos y lactantes, necesitando intervenciones urgentes. El resto de las malformaciones intestinales (10-25%) afectan principalmente al intestino delgado y grueso. Suelen cursar con cuadros subagudos o recidivantes, y ocasionalmente pueden diagnosticarse en adultos, durante intervenciones quirúrgicas como apendicitis agudas o exploraciones radiológicas urgentes o programadas. Otras malformaciones más raras como las duplicaciones intestinales suelen presentarse como masas abdominales de aspecto pseudotumoral (1).
El objetivo del trabajo es presentar una serie de casos de malrotación intestinal en adultos diagnosticados en nuestro centro.
PACIENTES Y MÉTODOS
Estudio descriptivo y retrospectivo sobre los pacientes adultos diagnosticados en el Servicio de Cirugía General de nuestro Centro, en un periodo de 73 meses (diciembre 2006 a enero del 2013) y con seguimiento hasta mayo del 2014.
Nuestro centro se encuadra entre los hospitales del Grupo II del Sistema Nacional de Salud (SNS), con un Área Sanitaria de 211.613 habitantes (2).
El estudio se ha realizado según las recomendaciones de la Ley Orgánica 15/1999 de protección de datos de carácter personal.
Los datos del estudio se incluyeron en una base de datos (Access®) y una hoja de cálculo (Excel®). Se aplicó estadística descriptiva, con cálculo de porcentajes (variables categóricas) y de media/promedio con desviación estándar (variables continuas).
RESULTADOS
Desde diciembre del 2006 hasta diciembre del 2012 se han diagnosticado en nuestro centro 11 malrotaciones intestinales en adultos. En 2006 se diagnosticó 1 caso y del 2008 al 2012 se diagnosticaron 2 casos cada año. Las características generales se exponen en la Tabla I.
El grupo está compuesto por 8 hombres (73%) y 3 mujeres con edad media 51 años, DE 22, rango 22-79
De los 11 pacientes el 82% presentaron cuadros abdominales recurrentes, con ingresos previos en diferentes Servicios, sin que se les realizara el diagnóstico de malrotación, y sólo 2 acudieron con un cuadro abdominal brusco primario. Los 11 pacientes ingresaron por dolor abdominal, de distinta intensidad y localización, y obstrucción intestinal (27%); 9 de ellos por Urgencias (8 directamente a Cirugía y 1 a Medicina Interna). Otros 2 procedentes de las consultas externas de Aparato Digestivo.
La TAC abdominal resultó la técnica fundamental en Urgencias, realizándose 6 diagnósticos de malformación intestinal de los 8 estudiados (75%). La ecografía abdominal transcutánea resultó menos resolutiva (20%). De los 7 estudios realizados se diagnosticaron 2 apendicitis, 1 necrosis de ciego y 1 posible malrotación.
Se intervinieron el 91% de los pacientes (55% de urgencia y 36 % programados). Un paciente no se intervino. Los tratamientos quirúrgicos urgentes más frecuentes fueron la apendicectomía (4 casos), la liberación de asas de los sacos herniarios, con o sin fijación del ángulo de Treitz (3 casos), la resección intestinal por necrosis (1 caso), la cecectomía (1 caso) y una diverticulectomía de Meckel.
En las revisiones presentaron síntomas variados el 55%, el más frecuente fue el dolor abdominal recurrente. Además, ha habido un síndrome de intestino corto, una enfermedad intestinal inflamatoria y un aumento de la pirosis (reflujo gastroesofágico previo con hernia de hiato) y una intolerancia a glúcidos. Los otros 5 pacientes realizan vida normal, con escasa o nula sintomatología abdominal.
No hubo fallecimientos ni durante la intervención quirúrgica ni en el postoperatorio.
Pacientes adultos diagnosticados de malrotación intestinal
| Paciente | Edad | Sexo | Motivo primera intervención quirúrgica | Urgente/ programada | Exploraciones radiológicas diagnósticas |
| 1 | 50 | hombre | apendicitis aguda en fosa ilíaca izquierda | urgente | ECO |
| 2 | 24 | mujer | obstrucción intestinal | urgente | TAC |
| 3 | 31 | mujer | obstrucción intestinal | urgente | ECO/TAC |
| 4 | 48 | hombre | Dolor abdominal | Programada | Tránsito intestinal/TAC |
| 5 | 69 | hombre | Dolor abdominal | Programada | TAC |
| 6 | 71 | hombre | sin Cirugía | sin Cirugía | TAC |
| 7 | 73 | hombre | obstrucción intestinal | urgente | TAC |
| 8 | 67 | hombre | neoplasia cabeza de páncreas | Programada | TAC |
| 9 | 79 | hombre | isquemia intestinal | urgente | ECO |
| 10 | 26 | hombre | apendicitis aguda en fosa ilíaca izquierda | urgente | ECO/TAC |
| 11 | 22 | mujer | laparotomía exploradora | Programada | Tránsito intestinal/TAC |
Tabla I
La descripción detallada de los pacientes se expone a continuación.
Paciente 1. –
Ingresó urgente por dolor en fosa ilíaca izquierda. Mediante ecografía se diagnosticó de apendicitis aguda. En la intervención quirúrgica se efectuó una apendicectomía por laparotomía media. El diagnóstico postquirúrgico fue de apendicitis aguda gangrenada y perforada. Ángulo de Treitz en hipocondrio derecho, colon ascendente y ciego en hemiabdomen izquierdo. Años más tarde se realizó una colecistectomía abierta programada por colecistitis. Posteriormente el paciente presentó un cuadro suboclusivo que cedió espontáneamente.
Paciente 2. –
Antecedentes de episodios de dolor abdominal recurrente con TAC abdominal normal. Visto en Urgencias en otra ocasión por dolor abdominal difuso e hipotensión severa. Acudió de nuevo al servicio de Urgencias por presentar intenso dolor abdominal. En la TAC abdominal se observó dilatación de estómago, duodeno y todo el intestino delgado; abundante líquido libre intraperitoneal. Se practicó laparotomía media urgente apreciándose un vólvulo, una hernia interna y un divertículo de Meckel, se realizó reducción del vólvulo y de la hernia con resección de intestino necrosado, preservando unos 120 cm, apendicectomía, diverticulectomía del Meckel.
El diagnóstico quirúrgico final fue de malrotación de colon e intestino (colon izquierdo e íleon derecho), hernia intestinal entre el mesocolon y el asa fija. Vólvulo e isquemia de intestino delgado. Divertículo de Meckel a unos 50 cm de la válvula íleo-cecal. Posteriormente ha presentado un síndrome de intestino corto y un cuadro suboclusivo que no ha precisado cirugía.
Paciente 3.-
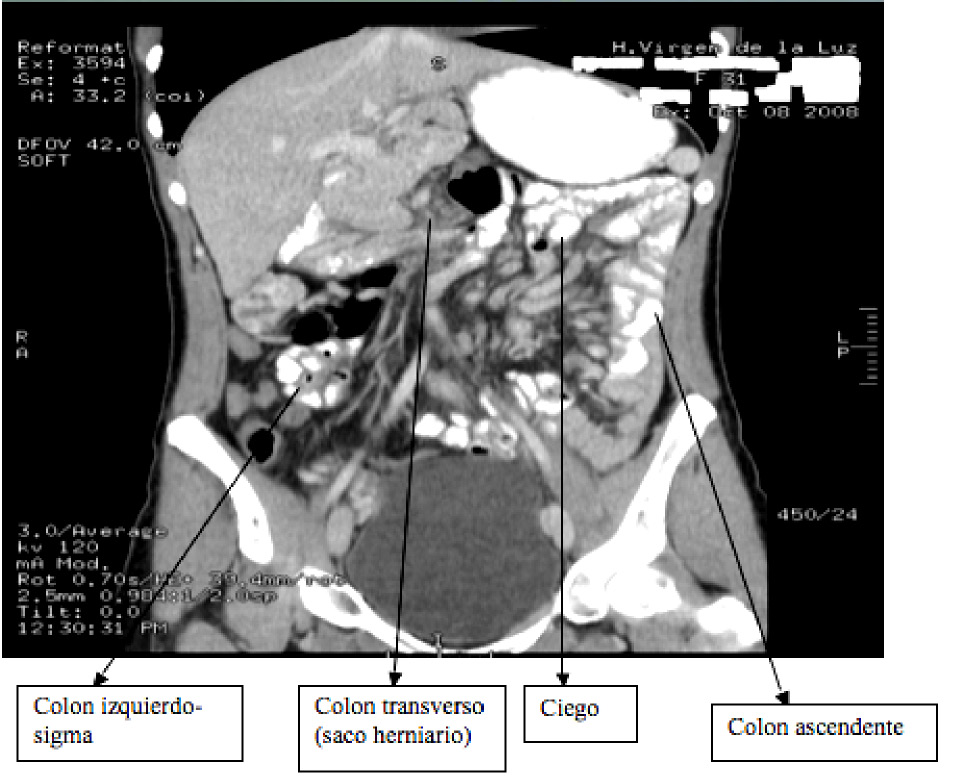
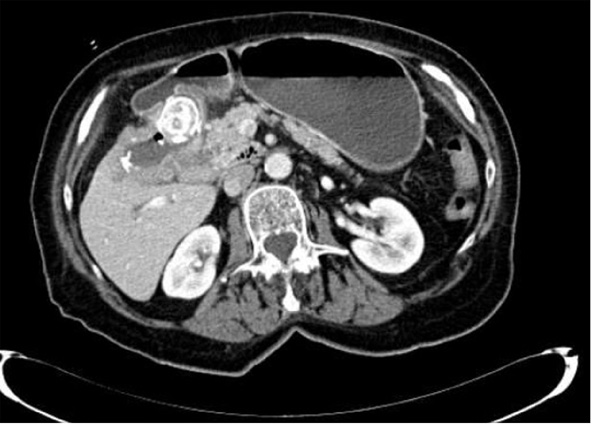
Acudió a Urgencias por dolor abdominal y vómitos. En la TAC abdominal se observó poliesplenia con malrotación y vólvulo de un asa yeyunal. Se realizó laparotomía media urgente. El diagnóstico quirúrgico final fue de malrotación intestinal incompleta (saco herniario interno, con colon transverso en su interior; asas de intestino delgado en abdomen derecho) y oclusión de colon e íleon. Malformación de epiplón y poliesplenia. Tras la cirugía el paciente no ha presentado recurrencias (Figura 1).

Paciente 4.-
Dolor abdominal crónico y pérdida de peso. En la TAC se apreció malrotación con vólvulo de intestino medio, dilatación de la vena mesentérica superior, girando con el mesenterio e intestino delgado alrededor de ella, y engrosamiento mural concéntrico de un segmento largo del íleon distal. Divertículos yeyunales y en colon izquierdo. Adenopatías mesentéricas. Se realiza una laparotomía programada, en la que se liberan las asas intestinales y se realiza una sutura del asa fija a la izquierda. El diagnóstico postquirúrgico es de malrotación de ciego; asa fija rotada a la derecha (antihoraria); múltiples divertículos en intestino delgado. En la evolución, el paciente presentó de nuevo crisis de dolor abdominal. Finalmente fue diagnosticado mediante capsula endoscópica de ileitis terminal por enfermedad de Crohn. Posteriormente ingresó por hemorragia digestiva baja. No pudo filiarse la causa. Lleva actualmente una vida normal.
Paciente 5 .-
Antecedentes de episodios de dolor abdominal recurrentes con ecografía abdominal transcutánea y tránsito intestinal baritado normales. Acudió a Urgencias por dolor periumbilical, brusco e intenso. En la TAC abdominal se apreciaron asas intestinales agrupadas en flancos derecho e izquierdo, con rotación y mal posición de su meso, y discreta dilatación desde el ángulo de Treitz. Hernia paraduodenal izquierda y otra pericecal derecha, con desplazamiento súpero-anterior de la vena mesentérica inferior y de la vena cólica izquierda. Se realizó laparotomía media programada, liberación del saco herniario paraduodenal (que incluía el 90% del intestino delgado), con orificio izquierdo debajo del duodeno; liberación del saco herniario paracecal superior, adhesiolisis y apendicectomía. El diagnóstico postquirúrgico fue malrotación intestinal, hernia paraduodenal izquierda y pericecal superior derecha. En la evolución posterior presentó un cuadro suboclusivo que se resolvió con tratamiento conservador. Vida normal en la actualidad (Figura 2).

Paciente 6.-
Antecedentes de episodios de dolor abdominal recidivante. Acudió a Urgencias en una ocasión por dolor intenso, náuseas y deposiciones escasas. En la TAC abdomen se apreció hernia intestinal interna y hernia de hiato. Asas intestinales localizadas en el flanco y fosa ilíaca izquierda con engrosamiento de su pared, estiramiento y alteración de la posición normal de los vasos mesentéricos El paciente mejoró con tratamiento conservador y decidió no operarse.
Paciente 7.-
Dolor epigástrico recurrente y meteorismo, con estreñimiento. Acudió a Urgencias por dolor abdominal. En la TAC de abdomen se apreció una posible herniación de asas de delgado en el flanco derecho y fosa ilíaca derecha, que presenta una localización retrocecal. Se realizó laparotomía media urgente con liberación de asas intestinales del saco herniario, comprobando su viabilidad, y fijación del ángulo de Treitz. El diagnóstico postquirúrgico fue: segmento ileal en el espacio paracecal herniado por un orificio membranoso en el espacio parietocólico derecho, con obstrucción intestinal, y múltiples divertículos en colon. El paciente ha llevado desde entonces una vida normal.
Paciente 8.-
Dolor abdominal recurrente, Se había realizado colecistectomía por cólicos biliares. Acudió a Urgencias por dolor abdominal. En la TAC se apreció tumoración en cabeza de páncreas, realizándose de forma programada una duodenopancreatectomía cefálica (Whipple). El diagnostico postquirúrgico fue de carcinoma ampular, malrotación intestinal, con yeyuno en el hipocondrio derecho. No precisó tratamiento oncológico. Buena evolución del dolor abdominal aunque presentó intolerancia a glúcidos.
Paciente 9.-
Acudió a Urgencias por dolor abdominal periumbilical, brusco e intenso, continuo e irradiado hacia fosa ilíaca derecha. En la ecografía abdominal transcutánea se apreció una probable isquemia de ciego. Se realizó laparotomía media urgente con cecectomía por isquemia. El diagnóstico post quirúrgico fue de ciego situado en el hipocondrio derecho, con isquemia. La evolución posterior ha sido normal.
Paciente 10.-
Antecedentes de dolor abdominal recurrente, epigástrico y dispepsia. Acudió a Urgencias por dolor abdominal. En la ecografía se apreció apéndice localizado en fosa ilíaca izquierda. En la TAC abdominal se observó que el colon ascendente y ciego estaban situados en fosa ilíaca izquierda con el íleon en hemiabdomen derecho y probable hernia interna, en la que no estaba incluida el ángulo de Treitz. También apendicitis aguda. Se realizó una laparotomía media urgente con apendicectomía. El diagnóstico postquirúrgico fue de ciego en fosa ilíaca izquierda, sin apreciarse hernia y apendicitis aguda. La evolución del paciente ha sido buena.
Paciente 11.-
Ingresó por dolor abdominal, diarrea y pérdida de peso. La ecografía abdominal fue normal. En un tránsito intestinal baritado se apreciaros asas ileales ocupando el espacio presacro, con estenosis hasta las asas yeyunales, con la apariencia de atravesar un un orificio herniario y el ciego situado en la pelvis, con probable hernia interna. En la TAC se apreciaron asas ileales en pelvis sin hernia interna y desplazamiento caudal del colon transverso y el ciego. Se realizó una laparoscopia exploradora programada con apendicectomía profiláctica. El diagnóstico postquirúrgico fue de ausencia de hernia interna. En la evolución persisten los dolores abdominales recurrentes. En un nuevo tránsito baritado se aprecian imágenes sugerentes de hernia interna.
DISCUSIÓN
La malrotación intestinal es una anomalía congénita de la rotación y fijación del intestinal delgado y grueso. El intestino queda mal posicionado durante la etapa de desarrollo fetal, exactamente entre la 5ª y la 12ª semana de gestación (1, 3, 4). Podemos clasificarlas en 3 tipos:
1.- Anomalías congénitas y obstrucción intestinal. Son las más frecuentes en el neonato y en el lactante, produciendo cuadros agudos obstructivos duodenales.
2.- Malrotación intestinal. O bien por alteraciones en la rotación intestinal o por alteraciones de la fijación intestinal en los procesos de coalescencia.
3.- Hernias internas congénitas. I) Las más comunes son hernias a través de las fosas paraduodenales y representan más del 50%. II) Hernias a través de las fosas pericecales. En todas puede introducirse y obstruirse un asa intestinal. Suelen tener lugar durante la adolescencia o en la edad adulta.
La incidencia es variable, desde 1/500 nacidos vivos o hasta 2,86/100.000 incluyendo nacidos vivos y muertes fetales (3, 4). En autopsias es de 3/10.000 (0,03%), y en adultos con pruebas radiológicas digestivas baritadas de 0,2% (5, 6). El 75-90% se descubren durante el primer año de vida y el 10-25% posteriormente (3, 5, 6).
En adultos la clínica varía desde cuadros repetitivos de dolor abdominal, con ingresos y estudios consecutivos, hasta dolor abdominal agudo. En los casos presentados en esta serie el 55% de los pacientes precisaron de una intervención urgente. El abdomen agudo se debió a apendicitis aguda, obstrucción intestinal e isquemia intestinal. El 36% precisaron de una intervención programada. Uno se los pacientes (8%) no fue operado. Hay que tener presente que casi todos los pacientes habían presentado previamente cuadros de dolor abdominal inespecíficos. La variabilidad sintomática y su baja sospecha clínica dificultan el diagnóstico.
Esporádicamente, las malrotaciones se asocian a otras anomalías anatómicas (situs inversus, duplicaciones, poliesplenia) (7, 8, 9); en nuestra serie 1 paciente presentó poliesplenia y alteraciones vasculares.
La radiología es esencial para realizar el diagnóstico. En los pacientes sin cuadro abdominal agudo puede realizarse un tránsito intestinal baritado. Tanto en pacientes paucisintomáticos como en aquellos evaluados por abdomen agudo, la TAC abdominal suele diagnosticar malformaciones con un 80% de exactitud (6, 10). En nuestra serie, la TAC abdominal urgente ha sido la herramienta principal para el diagnóstico (86% en esta serie). La ecografía abdominal transcutánea ha tenido una tasa muy baja de diagnóstico (20%) (3, 4, 6, 10, 12).
El tratamiento de elección es la cirugía. Los casos crónicos o repetitivos permiten completar los estudios de forma ambulatoria y plantear una intervención programada. En los casos urgentes, con patología abdominal aguda, es preciso realizar una laparotomía lo más pronto posible, para evitar isquemia de asas intestinales. Las técnicas de elección son la de Ladd (lisis de bandas peritoneales, reducción del vólvulo, apendicectomía y fijación intestinal), y/o actuaciones según los hallazgos (adhesiolisis, cecopexias, duodenopexias, resecciones intestinales, de divertículo de Meckel y otras) (3, 4, 6, 8, 11, 12).
Las complicaciones intestinales, en el seguimiento de los pacientes, pueden ser variadas, junto con manifestaciones de otras patologías acompañantes (situs inversus, anomalías de la cava) (3, 7, 8, 12). En nuestra serie ha habido cuadros de pseudo-oclusión y 4 pacientes presentaron hernia de hiato y con reflujo gastroesofágico.
El paciente número 11 (Tabla I) ejemplifica la dificultad que existe en el diagnóstico en adultos. En un tránsito intestinal baritado se le diagnosticó de probable hernia interna (que no apreció en la TAC). En la laparoscopia exploradora programada, sin hallarla. Al persistir los síntomas, meses después se realizó otro tránsito baritado con diagnóstico similar de hernia interna.
Como conclusión, la malrotación intestinal es un cuadro clínico poco frecuente en el adulto, con episodios recurrentes de dolor abdominal muchas veces inespecíficos. Para el diagnóstico es importante la sospecha clínica. Entre las pruebas radiológicas que apoyan el diagnóstico están el tránsito intestinal baritado y la TAC. El tratamiento es quirúrgico. Urgente en la mayor parte de los casos (55% en esta serie). Es frecuente la recurrencia de síntomas abdominales menores que no suelen necesitar cirugía.
BIBLIOGRAFÍA
1. Méndez J. Afecciones congénitas del intestino. En: Durán H; Arcelus I; García-Sancho L; González F; Álvarez J; Ferrández L; Méndez J, editores. Compendio de cirugía. Madrid: Edit. McGraw-Hill Interamericana, S.A.U. 2003: 675-679.
2. Padrón Municipal de habitantes 2013. Instituto Nacional de Estadística. Ministerio de Economía y Hacienda.
3. Ojeda M; Prochazka R; Vila S; Picoya A; de los Ríos R; Pinto J.L; Huerta-Mercado J; et al. A. Malrotación intestinal en el adulto. Rev Gastroenterol Perú 2006; 26: 395-9.
4. Lubinus FG; Rojas S P; Salcedo C J. Malrotación intestinal como causa de dolor abdominal en adultos. Revisión de un caso. Med UNAB 2006; 9 (2):156-8.
5. Díaz-Aguirregoitia J; Quintana A; Pérdigo L; Echenique-Elizondo M. Malrotación intestinal tras la infancia. Cir Esp 2005; 78:392-4.
6. Zarzosa G; Pacheco P; Fernández B; García C; Fernández J.M; Loinaz C; Quintans A. Malrotación intestinal en adulto y apendicitis aguda. Rev Esp Enf Dig 2007; 99 (9).
7. Echenique M; Urkía J.M. Situs inversus totalis. Primera descripción científica realizada durante la Ilustración en México. Cir Esp 2001; 70: 247- 50 (5).
8. Kobus Ch; Targarona E; Alonso V; Moya I; Bendahan E; Cherichetti C; Balagué C; et al. Cirugía laparoscópica y situs inversus. Revisión de la literatura y presentación de un caso de sigmoidectomía por diverticulitis. Cir Esp 2003; 73: 381- 4.
9. Moya A; Orbis JF; Alberola C; Sanjuán F; Juan M; Mir J; Peiró F; et al. Duplicación gástrica en el adulto. Caso clínico. Cir Esp. 2000; 68: 498-500.
10. Vázquez Muñoz E; Ramiro Ramiro E; Pérez Villacastín B; Learra MartínezMC; Franco López MA. Tomografía computada en el diagnóstico de la malrotación intestinal. Rev Argent Radiol 2004; 68: 33.
11. Klein M; Farmer D. Estenosis pilórica y obstrucción duodenal congénitas. En: Baker R; Fischer J, editores. El dominio de la cirugía. Buenos Aires: Edit Médica Panamericana 2004: 1158-68.
12. Vila Blanco J.M; Malrotación intestinal en adultos. A propósito de 4 casos clínicos. Rev Esp de Inv Quirúrgicas 2009; 12(3): 135-40.
Aspectos en la implementación de consultas de alto riesgo en cáncer de páncreas
Aspectos en la implementación de consultas de alto riesgo en cáncer de páncreas
de la Morena López F, Prados Leira S
Unidad de Aparato Digestivo-Endoscopias. Hospital Universitario Madrid-Norte Sanchinarro.
Trabajo Enviado: 6/02/2015
Aceptado para su publicación: 7/03/2015
INTRODUCCIÓN
El cáncer de páncreas (CP) es una enfermedad poco conocida en relación a su etiopatogenia y de pronóstico infausto, con una supervivencia inferior al 5% a los 5 años. Este hecho se relaciona principalmente con el diagnóstico en fases avanzadas de la enfermedad, siendo del 80-90% de los pacientes diagnosticados en estadíos irresecables de inicio.
Las lesiones precursoras del CP están siendo progresivamente mejor estudiadas y comprendidas, mejorando el tratamiento y el abordaje de estos tumores en fase precoz y evitando su desarrollo. Además de las lesiones quísticas mucinosas, las neoplasias pancreáticas intraepiteliales (panIN) han suscitado el interés de los investigadores al tratarse de lesiones potencialmente precursoras del CP. La panIN-2 (displasia de bajo grado) y pan-IN3 (alto grado, carcinoma in situ) resultan de especial relevancia. La ultrasonografía endoscópica (USE) se constituye como el método de elección para el estudio pancreático dada la posibilidad de obtener material para estudio patológico y la posibilidad de estudio de cambios mínimos en el parénquima. La cirugía en estadíos precoces del CP (T1; lesiones < 20 mm) conlleva una resecabilidad del 99% con unas tasas de supervivencia, en caso de que la lesión finalmente estuviera confinada al páncreas tras estudio histopatológico (37% del total), superiores al 35% a los 5 años (1).
Los procesos neoproliferativos pancreáticos se pueden dividir en dos categorías: endocrinos y exocrinos, siendo estos últimos los más frecuentes (90-95%). EL CP exocrino (adenocarcinoma, tumor mucinoso papilar intraductal, tumor sólido pseudopapilar y carcinoma acinar) es la cuarta causa de muerte por cáncer en Estados Unidos, con un aumento de la incidencia progresiva en la última década. Un mayor estudio y conocimiento de la enfermedad ha permitido la observación de agrupaciones ocasionales de CP en determinadas familias, lo que ha “abierto la puerta” al estudio de los posibles condicionantes genéticos de dicha enfermedad. Así, aunque la mayor parte se consideren esporádicos, se estima que entre el 5-10% de los casos de CP forman parte de algún síndrome familiar.
Podemos dividir la agrupación familiar del CP en tres grupos de enfermos: familias que desarrollan CP en el seno de algún síndrome genético conocido con predisposición a malignidad pancreática, familias con pancreatitis hereditaria y por último familias con (quitar este con) dónde múltiples miembros desarrollan CP sin asociación con ningún síndrome conocido (Tabla I). Otras enfermedades poligénicas con menor impacto en el desarrollo de CP y consideradas como factores de riesgo para el desarrollo son la diabetes, obesidad y pancreatitis crónica serán también discutidas. La detección y definición del paciente en alto riesgo será un objetivo fundamental de la consulta monográfica para establecer sobre él las actividades preventivas y de vigilancia oportunas con el fin de reducir su riesgo individual y detectar en fases iniciales las lesiones con potencial curativo.
Síndromes genéticos asociados a cáncer de páncreas
| Síndrome | Mutaciones | Riesgo relativo CP |
| Peutz-Jeghers | STK11/LKB1 | 36- |
| Lynch | MLH1, MSH2 | Incrementado pero <5 |
| FAMM | CDKN2 | 16- |
| MEN-1 | MENIN | >10 |
| Síndrome mama-ovario | BRCA2 | 10- |
| Pancreatitis hereditaria | PRSS1, SPINK1 | >50 |
| P hereditario | – | 18-57 en función de nº afectos |
Tabla I
SÍNDROMES FAMILIARES Y CÁNCER DE PÁNCREAS
-
NEOPLASIAS PANCREÁTICAS ENDOCRINAS HEREDITARIAS
Estas lesiones se pueden presentar de forma esporádica o en asociación con síndromes genéticos. En general presentan una baja incidencia, la cual se estima entre 1-5 casos por millón de habitantes al año. Poco se conoce sobre las posibles bases genéticas de las lesiones esporádicas pero sí en las de componente hereditario. Principalmente la neoplasia endocrina múltiple (MEN-1) y en menor grado la esclerosis tuberosa (hamartomatosis) y el Von Hippel Lindau (carcinoma renal, angiomas en el sistema nervioso central, feocromocitoma y quistes y/o adenomas en hígado, páncreas, riñón) son factores de riesgo genético para el desarrollo de este tipo de tumores.
La MEN-1 es una rara enfermedad autonómico dominante caracterizada por la formación de múltiples tumores primarios endocrinos paratiroideos, hipofisarios y pancreáticos. La alteración de la menina producida por la mutación en dicho gen se traduce en una reducción de la capacidad supresora transcripcional de la misma con la capacidad oncogenética descrita. La edad de inicio de la afectación revela una penetrancia edad-dependiente del 45% a los 30 años, del 82% a los 50 años y del 96% a los 70 años, lo que incide en la importancia de la detección precoz y tratamiento. Existen test genéticos con una capacidad diagnóstica de hasta el 50% de las mutaciones relacionadas (2). Desde el punto de vista de los tumores endocrinos pancreáticos se ha de establecer en pacientes portadores o familiares de primer grado afectos de MEN-1 cribado mediante exploraciones de imagen pancreática bianual a partir de los 15 años de edad dada su elevada penetrancia.
-
NEOPLASIAS PANCREÁTICAS EXOCRINAS HEREDITARIAS (Tabla I)
1. Peutz-Jeghers
Síndrome autosómico dominante derivado en el 50% de los casos de la mutación de la serina-treonina kinasa (LKB1/STK11), la cual está implicada en la proliferación y polarización celular y en la vía mTOR. El efecto neto de dicha acción es la supresión tumoral que en estado mutacional pierde su capacidad.
Clínicamente cursa con la aparición de hiperpigmentación mucocutánea y pólipos hamartomatosos gastrointestinales múltiples. Se encuentra así aumentada la probabilidad de carcinoma esófago-gástrico, pulmón, intestino delgado, mama, útero, ovario y CP. Desde el punto de vista pancreático los pacientes presentan un aumento de riesgo de hasta 132 veces para el desarrollo de CP, con un riesgo acumulado a los 64 años del 36% (3). Otra lesión pancreática especialmente frecuente en este grupo de enfermos es el tumor mucinoso papilar intraductal (TPMI). De hecho se encuentran mutaciones de LKB1/STK11 en el 32% de los TMPI de la población general sin Peutz-Jeghers asociado, lo que relaciona causalmente ambos hechos.
2. Síndrome de Lynch
Síndrome autonómico dominante del que se deriva una elevada predisposición para cáncer colorectal. Se han implicado varias mutaciones de genes reparadores del ADN (hMLH1, hMSH2, hMSH6, hPMS2), que ofrecen como resultado una inestabilidad de microsatélites con un riesgo superior al 80% de padecer cáncer de colon proximal. Basado en este perfil se pueden distinguir dos subtipos sindrómicos: el tipo I sólo presenta predisposición a la neoplasia colorrectal; en el tipo II aparecen otros tumores asociados como ovario, gástrico, uterino, pancreático, biliar y urinario.
3. Síndrome de melanoma familiar atípico con
molas múltiples (FAMM)
Caracterizado por la presencia de nevus displásicos en asociación con otras malignidades como el CP. Causado por la mutación en el p16/CDKN2a localizado en el cromosoma 9p tiene una herencia de tipo autonómico dominante y alta penetrancia, en torno a un 80-100%. Las mutaciones del p16 se encuentran en más del 90% de los CP esporádicos, lo que relaciona causalmente ambas circunstancias. Se estima un riesgo relativo de 12-38 veces para CP y un riesgo acumulado del 17% a los 75 años (2). Se ha de establecer un elevado índice de sospecha de mutación del CDKN2a en pacientes con CP e historia familiar de melanoma.
4. Síndrome de cáncer hereditario mama/ovario
La relación entre las mutaciones BRCA1/BRCA2 con el aumento de riesgo de cáncer de mama y ovario está bien establecida. Las mutaciones en dichos genes presentan un patrón autonómico dominante con penetrancia incompleta, realizando un efecto supresor oncogénico. Se estima que del 5-10% de tumores de ovario se relacionan con las mutaciones del BRCA1/2. A su vez es bien conocido como las mutaciones del BRCA2 (13q) se relacionan con la aparición de CP, siendo el tercer tumor más frecuente en familias portadoras de dicha mutación. De hecho, no es infrecuente la aparición de dicha mutación en pacientes sin historia familiar de cáncer de mama, lo que confiere al BRCA2 y el CP una entidad propia. Globalmente se estima un riesgo relativo 10 veces mayor que en la población general (4).
5. Pancreatitis Hereditaria
Las mutaciones que se asocian a este síndrome clínicamente se manifiestan por el desarrollo precoz de episodios de pancreatitis aguda de tipo idiopático. Se han relacionado mutaciones de las enzimas pancreáticas con activación precoz intraglandular que origina cuadros de pancreatitis subclínica desde los 20 años de edad (PRSS1, SPINK1). Otras proteínas no exclusivas del páncreas como el intercambiador de cloro de membrana (CFTR) promueven la de la fibrosis quística (5). Por otro lado la pancreatitis tropical, propia de regiones como India y África subsahariana y también de base genética pero independiente de las anteriores, presenta características clínicas similares pero con la formación de cálculos intraductales de gran tamaño; en esta entidad se generan ya en la adolescencia de datos de insuficiencia pancreática mixta y aumenta el riesgo de cáncer pancreático al 5-100 (6).
• PRSS1 (7q35) codifica para el tripsinógeno, una serin-proteasa normalmente producida y secretada en el páncreas en forma inactiva hasta su activación en el intestino delgado. Es la alteración genética más frecuente, en torno al 70% de los casos. La mutación sobre PRSS1, hereditaria de manera autosómica dominante (no coma) en sus formas más frecuentes (R122H y N29I) traduce la activación de la enzima intraglandular, lo que produce la autodigestión pancreática y el fenómeno inflamatorio secundario. Así y a diferencia de las anteriores, el efecto mutacional no se evidencia en una alteración oncogénica determinada sino que el efecto neoplásico se deriva de los sucesivos fenómenos de inflamación, regeneración y fibrosis de las sucesivas pancreatitis. El riesgo relativo de CP a los 70 años se estima entre el 53-70% de los pacientes afectos por esta mutación. En caso de tabaquismo activo la cifra se eleva hasta las 150 veces.
• SPINK1 y sus variantes denotan una herencia autosómico recesiva con penetrancia variable, por lo que raramente las familias de los pacientes afectos presentan historia de pancreatitis de repetición. El efecto neto de la alteración es un disbalance entre las proteasas y sus inhibidores a nivel intrapancreático, con la activación prematura (nuevamente) de la tripsina con los mismos efectos que PRSS1. El riesgo de CP se encuentra también aumentado en esta variante.
• Las mutaciones sobre el gen de la fibrosis quística (CFTR) se asocian también a formas precoces e idiopáticas de pancreatitis aguda. Estas mutaciones se encuentran hasta en el 5% de la población y serían las responsables de hasta el 50% de pancreatitis agudas idiopáticas. De hecho, y aunque para el desarrollo de fibrosis quística por su herencia recesiva sea preciso la unión de dos portadores por su herencia recesiva, para la manifestación de pancreatitis aguda recurrente sólo precisa de una única mutación (7).
6. Cáncer pancreático familiar
La agregación de casos de CP en familias se encuentra en alrededor del 10% de todos los casos. La ausencia de síndrome genético conocido y la aparición en la misma familia de al menos dos afectos de primer grado determinan el síndrome conocido como cáncer pancreático familiar. Así, el riesgo de un individuo con dos familiares de primer grado afectados por CP eleva su probabilidad individual hasta las 18 veces, aumentando de 32 a 45 si hay tres ó más (Tabla II) (8), no negrita. Aunque las bases genéticas de esta forma sigan siendo desconocidas se han realizado avances en el ámbito genético; la presencia de mutación BRCA2 se ha evidenciado en el 6-17% de estas familias.
Riesgo de desarrollo de cp en formas de cáncer pancreático familiar
| Número de familiares afectos | Incremento de Riesgo Relativo |
| 1 | 4-5 veces |
| 2 | 18 veces |
| >3 | 2 a 57 veces |
Tabla II
III. OTROS FACTORES DE RIESGO
1.- Diabetes mellitus
Metanálisis recientes demuestran que la presencia de diabetes aumenta en 2,1 veces el riesgo relativo de padecer un CP, especialmente tras los 5 primeros años tras el diagnóstico (9). Aún cuando dicha asociación exista no se puede considerar la diabetes de forma aislada como un factor con un peso relevante para determinar de forma individual un paciente como en riesgo de CP. Sin embargo el CP sí se relaciona de forma importante con la producción de intolerancia a los hidratos de carbono; la diabetes acontece entre el 50-65% de CP, ocurriendo con una asociación temporal muy próxima al inicio de la actividad tumoral. Así, pacientes con debut diabético por encima de los 50 años de edad presentan un riesgo individual para CP de hasta 10 veces en los tres primeros años tras el diagnóstico. Por todo ello se postula la intolerancia a los hidratos de carbono como un posible test de screening para el CP resecable.
2.- Obesidad
De forma aislada no conforma un elemento de peso relevante para el desarrollo de CP pero sí un aumento discreto del riesgo. Pacientes con un índice de masa corporal (IMC) >30 presentan un aumento de riesgo de 1,81 veces respecto a IMC <25, con una estratificación por sexos en varones con más de 35 de IMC de 2,61 veces y mujeres con más de 40 de IMC de 2,76 (10).
3.- Pancreatitis crónica
Los pacientes con pancreatitis crónica presentan un riesgo relativo individual de 14,4-16,5 veces más de riesgo para CP, siendo la pancreatitis crónica secundaria a pancreatitis hereditaria recurrente un factor de riesgo separado y mucho más importante en su potencial degenerativo que el resto de causas. Así, y aunque sólo 1-2% de los pacientes con pancreatitis crónica generen un CP, la incidencia acumulada de lesiones malignas se sitúa en torno al 2% por década, estando muy relacionado con la edad (3 veces más en pacientes de 40-60 años y hasta 10 veces más en pacientes de 60 años) y con el consumo de alcohol y tabaco, que duplican todos los datos anteriores en caso de consumo activo (11).
4.- Miscelanea
Ataxia-Telangiectasia, Anemia de Fanconi, Poliposis Adenomatosa familiar y Li-Fraumeni
Son factores de escasa relevancia, con bajo impacto en el riesgo individual o relacionados pero de riesgo desconocido.
CRIBADO Y MÉTODOS DIAGNÓSTICOS
El objetivo último de las estrategias de cribado y vigilancia ha de ser el caracterizar lesiones precoces y sin capacidad de invasión que las definan como no resecables. Las lesiones precursoras de neoplasia pancreática son las quísticas mucinosas (caracterizadas en otro protocolo) y las neoplasias pancreáticas intraepiteliales o PanINs. Éstas últimas tienen un interés especial por su difícil diagnóstico e importancia como fases iniciales de la mayor parte de adenocarcinomas pancreáticos. Las PanINs se componen generalmente de epitelio columnar y cuboidal con varios grados de atipia, afectando a los ductos pancreáticos pequeños y (quitaría el que) son indetectables en las pruebas de imagen convencionales. Las PanIN1 son hiperplásicas con un mínimo grado de atipia y pueden subdividirse en tipo A ó B en función de de la presencia o ausencia de crecimientos micropapilares respectivamente. Por otro lado las PanIN2 son lesiones con displasia de bajo grado e incluyen cambios celulares, pérdida de polaridad, pseudoestratificación, hipercromatismo y núcleos alargados. Por último las PanIN3 son lesiones de alto grado o carcinoma in situ, con la presencia de mitosis atípicas, necrosis luminal pero contenidas por la membrana basal (12).
Sensibilidad y especificidad de los estudios de imagen y diagnóstico molecular en cp
Global CP | CP< 2cm | CP<1cm | ||
| Test | Sensibilidad | Especificidad | Sensibilidad | Especificidad |
| Ecografía abdominal | 56-97 | 50-90 | 65 | 23 |
| TAC abdominal | 53-91 | 53-93 | 40-65 | 15 |
| RMN | 83-87 | 81-100 | 33 | – |
| CPRE | 70-97 | 81-100 | 93 | 91 |
| Ecoendoscopia | 86-100 | 69-100 | 74-90 | – |
| p53 en líquido pancreático | 42-67 | 59-100 | – | – |
| k-ras en líquido pancreático | 63-100 | 50-100 | – | – |
Tabla III
Genéticamente se identifica la presencia de mutaciones como k-ras, p16 y alargamiento telomérico en un gran número de estas lesiones. La detección de k-ras mutado en el jugo duodenal o pancreático aspirado tras estimulación con secretina es muy sensible aunque poco específico, particularmente en pacientes con pancreatitis crónica. La presencia de p53, CDKN2A y SMAD4 resulta menos sensible pero más específica para displasia. Se ha propuesto una estrategia escalonada (EUROPAC) basada en los resultados del aspirado mediante CPRE de fluido pancreático con la detección secuencial, en caso de que k-ras fuese positivo, de los otros marcadores como valores de detección precoz de CP inicial (13). Se sugiere que estas lesiones, al encontrarse en comunicación con el sistema ductal pancreático, pueden promover niveles elevados de dichos marcadores en fluido pancreático, lo cual demuestra utilidad como potencial método de diagnóstico precoz.
Estratificación pacientes en función del riesgo genético
| Bajo riesgo (<5) | Riesgo moderado (5-10) | Alto riesgo (>10) |
| Un familiar CP Mutantes portadores BRCA2 Pancreatitis hereditaria | Mutantes portadores BRCA2 | Pancreatitis hereditaria |
| Lynch | Pacientes con fibrosis quística | Peutz-Jeghers |
| Mutantes portadores BRCA1 | Pacientes con pancreatitis crónica | MEN-1 |
| Poliposis adenomatosa familiar | Un familiar de primer grado con CP menor de 55 años Dos familiares con CP independientemente del grado | Tres o más familiares independientemente del grado con CP Dos familiares con CP, uno de primer grado y otro de segundo siendo uno menor de 55 años Dos o más familiares de primer grado CP FAMM |
Tabla IV
Aunque no se produzcan cambios patognomónicos en el parénquima pancreático la ecoendoscopia es el único método definido como útil para la valoración de estas lesiones, siendo la mejor prueba diagnóstica para lesiones neoplásicas subcentimétricas en el cual se englobarían las PanIN. Aunque los cambios producidos por los PanIN sean superponibles a los de la pancreatitis crónica, la presencia de micromódulos hipoecoicos se ha sugerido como el factor más correlacionable con estas lesiones sobre otros (lo quitaría) (14). Adicionalmente la ecoendoscopia aporta el teórico potencial diagnóstico de la PAAF, aunque su rentabilidad en el seno de la detección de las PanIN2-3 no ha sido aún contrastada. La progresión de dichas lesiones, aún en estadíos precoces, promoverá alteraciones ductales potencialmente diagnosticables mediante RMN pancreática y/o CPRE, dejando ésta última opción por su carácter invasivo como método para el estudio de marcadores en el fluido pancreático (Tabla III) (15)
Con el fin de estratificar correctamente a los pacientes en función de su riesgo y para la optimización de los recursos en una consulta de cáncer pancreático familiar se han establecido tres grupos de enfermos. Se consideran de bajo riesgo aquellos con un riesgo acumulado menor de 5, (quitado los) de riesgo intermedio si es de 5-10 y con riesgo alto si es mayor de 10 (Tabla IV). (16)
Se establece adecuada la indicación de cribado y vigilancia a todos los pacientes con riesgo alto y moderado, siendo sólo incluidos en la consulta aquellos pacientes con riesgo bajo que así lo soliciten.
La edad adecuada para iniciar el cribado no ha sido establecida, por lo que se suele extrapolar de consideraciones relacionadas con el cáncer colorectal. Así, se recomienda su inicio a partir de los 50 años ó 10 años antes del familiar afecto más joven de la estirpe. Sin embargo se han encontrado familias afectas con cierto componente de anticipación genética en las sucesivas herencias por lo que el inicio puede incluso adelantarse más en la edad, especialmente y hasta 10 años más en pacientes fumadores. La únicas indicaciones claras al respecto las conforman los pacientes con MEN-1, con indicación de exploración pancreática bianual a partir de los 15 años de edad, Peutz-Jeghers a partir de los 25-30 años y pancreatitis hereditaria con una frecuencia anual a partir de 40 años. En relación al resto de síndromes la frecuencia de las exploraciones se recomienda bianual o incluso cada 3 años hasta la edad del primer familiar afecto y anual a partir de la misma (17).
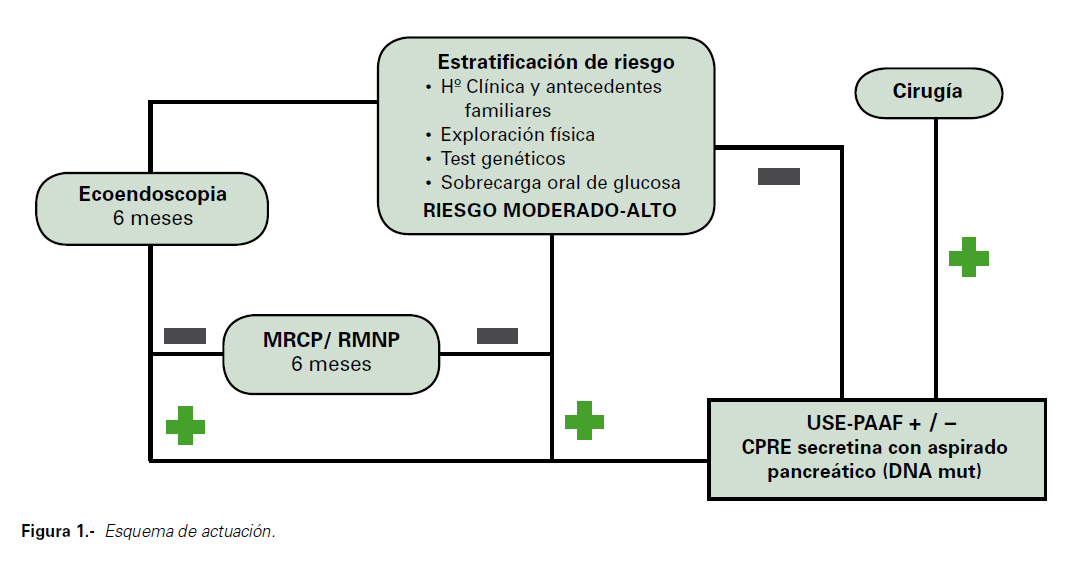
Se propone un esquema de actuación (Figura 1).

ACTUACIONES TERAPÉUTICAS
-
ACTUACIONES ENCAMINADAS A LA REDUCCIÓN DE RIESGO INDIVIDUAL
1.- Dieta y ejercicio
Se ha de recomendar dieta y ejercicio físico regular a todos los familiares ya que en estudios epidemiológicos la ingesta de grasa, exceso de calorías e hidratos de carbono se ha asociado con un riesgo aumentado de CP; las dietas ricas en fruta y verduras lo reducen poblacionalmente. De igual forma, las poblaciones que realizan semanalmente 1,5 horas de ejercicio físico suave presentan un 50% menos de incidencia de CP que aquellas totalmente sedentarias (18).
2.- Ingesta de alcohol
La eliminación de este factor de riesgo sólo previene la aparición de CP si se suprime previamente a la formación de pancreatitis crónica. Como se comentó anteriormente, la pancreatitis crónica es un factor de riesgo independiente para CP.
3.- Tabaquismo
Es un factor clave y claramente relacionado con el CP, aumentando el riesgo en 2-3 veces en la población general pero duplicándolo y haciendo su aparición más precoz en la población de riesgo. Se considera que si se produjera el cese completo del tabaquismo a nivel mundial la prevalencia de CP caería en un 22% (19).
4.- Tratamiento farmacológico
Se ha especulado sobre cómo el uso de AINE´s podría reducir el riesgo teórico de CP. Estudios epidemiológicos no verifican dicha hipótesis por lo que no se recomienda su uso como quimioprevención.
-
TRATAMIENTO QUIRÚRGICO
Una vez que la lesión displásica ha sido diagnosticada en un paciente de alto riesgo el mejor tratamiento disponible es la resección quirúrgica en términos de reducción en la mortalidad por CP. Sin embargo el carácter multifocal de los PanIN convierte la extensión de la cirugía pancreática en un punto controvertido. El hallazgo de lesiones tipo PanIN en los fragmentos resecados infiere un carácter multifocal hasta en el 73% de los pacientes en algunas series. Por ello son aceptables tres tipos de actitudes a consensuar con el paciente en función de su riesgo y características, ya que no existe hoy en día actitud de consenso clara al respecto:
a) Pancreatectomía total inicial.
b) Pancreatectomía distal y en caso de hallazgo de PanIN multifocal o tipo 3 proceder a completar la cirugía a total en un segundo tiempo.
c) Pancreatectomía distal y vigilancia estricta del muñón residual.
NOTA DEL AUTOR
El presente protocolo no presenta conflictos de interés y ha sido elaborado mediante búsqueda sistemática bibliográfica de revisiones y originales
BIBLIOGRAFÍA
1. Tsuchiya R, Noda T, Harada N, Miyamoto T, Tomioka T, Yamamoto K, et al. Collective review of small carcinomas of the pancreas. Annals of Surgery 1986;203(1):77-81.
2. Nagy R, Sweet K, Eng C. Highly penetrant hereditary cancer syndromes. Oncogene 2004;23(38):6445-70.
3. Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, et al. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology 2000;119(6):1447-53.
4. Greer JB, Whitcomb DC. Role of BRCA1 and BRCA2 mutations in pancreatic cancer. Gut 2007;56(5):601-5.
5. Simon P, Weiss FU, Sahin-Toth M, Parry M, Nayler O, Lenfers B, et al. Hereditary pancreatitis caused by a novel PRSS1 mutation (Arg-122 –> Cys) that alters autoactivation and autodegradation of cationic trypsinogen. The Journal of Biological Chemistry 2002;277(7):5404-10.
6. Chari ST, Mohan V, Pitchumoni CS, Viswanathan M, Madanagopalan N, Lowenfels AB. Risk of pancreatic carcinoma in tropical calcifying pancreatitis: an epidemiologic study. Pancreas 1994;9(1):62-6.
7. Teich N, Mossner J. Hereditary chronic pancreatitis. Best Practice & Research Clinical Gastroenterology 2008;22(1):115-30.
8. Klein AP, Brune KA, Petersen GM, Goggins M, Tersmette AC, Offerhaus GJ, et al. Prospective risk of pancreatic cancer in familial pancreatic cancer kindreds. Cancer Research 2004;64(7):2634-8.
9. Eberle MA, Pfutzer R, Pogue-Geile KL, Bronner MP, Crispin D, Kimmey MB, et al. A new susceptibility locus for autosomal dominant pancreatic cancer maps to chromosome 4q32-34. American Journal of Human Genetics 2002;70(4):1044-8.
10. Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. The New England Journal of Medicine 2003;348(17):1625-38.
11. Yeo TP, Hruban RH, Brody J, Brune K, Fitzgerald S, Yeo CJ. Assessment of “gene-environment” interaction in cases of familial and sporadic pancreatic cancer. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract 2009;13(8):1487-94.
12. Hruban RH, Adsay NV, Albores-Saavedra J, Compton C, Garrett ES, Goodman SN, et al. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. The American Journal of Surgical Pathology 2001;25(5):579-86.
13. Vitone LJ, Greenhalf W, McFaul CD, Ghaneh P, Neoptolemos JP. The inherited genetics of pancreatic cancer and prospects for secondary screening. Best Practice & Research Clinical Gastroenterology 2006;20(2):253-83.
14. Kimmey MB, Bronner MP, Byrd DR, Brentnall TA. Screening and surveillance for hereditary pancreatic cancer. Gastrointestinal Endoscopy 2002;56(4 Suppl):S82-6.
15. Pongprasobchai S, Chari ST. Management of Patients at High Risk for Pancreatic Cancer. Current Treatment Options in Gastroenterology 2003;6(5):349-58.
16. Verna EC, Hwang C, Stevens PD, Rotterdam H, Stavropoulos SN, Sy CD, et al. Pancreatic cancer screening in a prospective cohort of high-risk patients: a comprehensive strategy of imaging and genetics. Clinical cancer research : an official journal of the American Association for Cancer Research 2010;16(20):5028-37.
17. Larghi A, Verna EC, Lecca PG, Costamagna G. Screening for pancreatic cancer in high-risk individuals: a call for endoscopic ultrasound. Clinical cancer research : an official journal of the American Association for Cancer Research 2009;15(6):1907-14.
18. Michaud DS, Giovannucci E, Willett WC, Colditz GA, Stampfer MJ, Fuchs CS. Physical activity, obesity, height, and the risk of pancreatic cancer. JAMA : the journal of the American Medical Association 2001;286(8):921-9.
19. Yamaguchi K. How to define patients at high risk for pancreatic cancer. Pancreatology : official journal of the International Association of Pancreatology 2011;11 Suppl 2:3-6.
Desgarro mucoso profundo yatrogénico en paciente con esofagitis eosinofílica
Desgarro mucoso profundo yatrogénico en paciente con esofagitis eosinofílica
Alcaide N, Lorenzo S, Berroa E, González G, Tafur C, Macho A, del Olmo L, González JM
Servicio de Aparato Digestivo.
Hospital Clínico Universitario de Valladolid.
Trabajo enviado: 11/02/2015
Aceptado para su publicación: 30/03/2015
Correspondencia:
Noelia Alcaide Suárez
Servicio de Aparato Digestivo.
Hospital Clínico Universitario
C/ Ramón y Cajal 3 • 47005 Valladolid, España
Tel: 983 42 00 00 ext 86270
CASO CLÍNICO
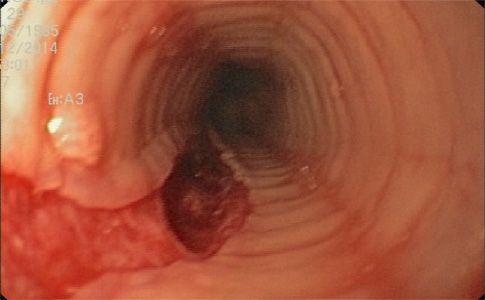
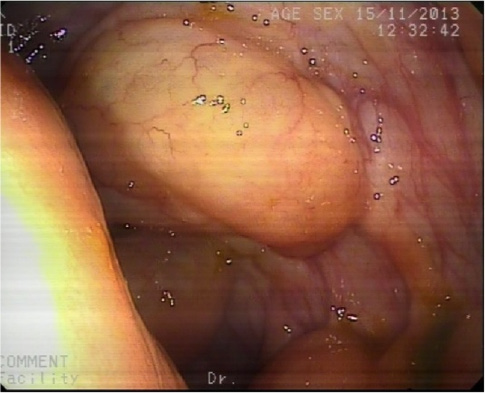
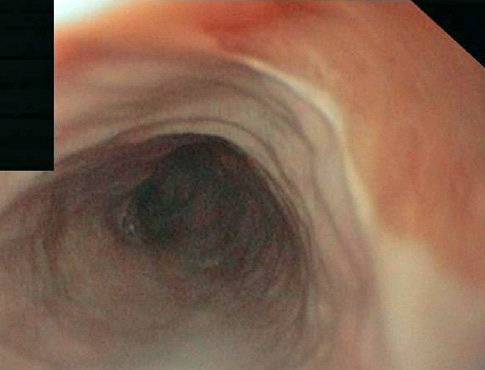
Paciente de 22 años diagnosticado siete años antes de enfermedad celiaca con adecuada respuesta a dieta sin gluten. En revisión rutinaria y aludiendo antecedentes familiares de primer grado de esofagitis eosinofílica (EoE), refiere disfagia de años de evolución y episodios de impactación alimentaria por los que nunca había tenido que acudir a urgencias. Se realiza gastroscopia tras tratamiento con inhibidores de la bomba de protones a altas dosis durante ocho semanas. En ella, se encuentra el esófago difusamente anillado, corrugado, con estrías longitudinales y exudados, hallazgos endoscópicos sugestivos de EoE. Se continúa con el procedimiento y se procede a tomar biopsias duodenales para comprobar respuesta histológica al gluten. En retirada, se observa de 33 a 40 cm de arcada dentaria, desgarro mucoso profundo producido por el decúbito del endoscopio mientras se completaba la realización de la gastroscopia (Figuras 1 y 2) y se procede a tomar biopsias del esófago distal y proximal. El paciente presenta buen estado general tras la exploración y no refiere dolor torácico ni disfagia. Se mantiene tratamiento con inhibidores de la bomba de protones a altas dosis y se le indica acudir a urgencias ante posibles incidencias. Evoluciona de manera favorable y las biopsias confirman el diagnóstico de EoE.
DISCUSIÓN
La EoE es una enfermedad crónica, inmune y mediada por antígenos que produce síntomas relacionados con disfunción esofágica (1). Histológicamente, presenta una infiltración crónica de eosinófilos y la formación de fibrosis a nivel subepitelial que conlleva la aparición de anillos esofágicos y estenosis (2). Afecta principalmente a varones con historia personal de procesos alérgicos y causa síntomas como disfagia, impactación alimentaria, odinofagia, pirosis y dolor torácico o abdominal (3). Clásicamente, los hallazgos endoscópicos que presentan estos pacientes, aunque inespecíficos, son anillos, surcos longitudinales, exudados blanquecinos, edema, fragilidad mucosa o estenosis (4) aunque pueden encontrarse ausentes hasta en un 30% (5). Presentan una mayor fragilidad de la mucosa esofágica con menor distensibilidad de la pared (6) con riesgo aumentado de desgarros mucosos y de perforación en el contexto de procedimientos diagnósticos y/o terapéuticos (7) o incluso de manera espontánea (8, 9). Sin embargo, la dilatación esofágica se considera un tratamiento eficaz y seguro que puede ocasionar desgarros mucosos, dolor torácico y odinofagia pero que no tiene aumentado el riesgo de perforación con respecto a otras causas de estenosis esofágica (10). No obstante, es importante extremar las precauciones en procedimientos endoscópicos en estos pacientes por la posibilidad de complicaciones graves derivadas de la instrumentación (11).
BIBLIOGRAFÍA
1. Molina-Infante J, Lucendo AJ. Eosinophilic esophagitis: a practical approach to diagnosis and management. Expert Rev Gastroenterol Hepatol 2014;8:925-34.
2. Ali Ma, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic and histopathologic review. Gastrointest Endosc 2012;76:1224-37.
3. Furuta GT, Liacouras CA, Collins MH, Gupta SK, Justinich C, Putnam PE, et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007;133:1342-63.
4. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol 2011;128:3-20.
5. Liacouras CA, Spergel JM, Ruchelli E, Verma R, Mascarenhas M, Semeao E, et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005;3:1198-206.
6. Sgouros SN, Bergele C, Mantides A. Eosinophilic esophagitis in adults: a systematic review. Eur J Gastroenterol Hepatol 2006;18:211-7.
7. van Rhijn BD, Curvers WL, Bergman JJ, Verheij J, Bredenoord AJ. Esophageal perforation during endoscopic removal of food impaction in eosinophilic esophagitis: stent wellspent? Endoscopy 2014;46 Suppl 1 UCTN:E193-4.
8. Gómez Senent S, Adán Merino L, Froilán Torres C, Plaza Santos R, Suárez de Parga JM. Rotura esofágica espontánea como inicio de una esofagitis eosinofílica. Gastroenterol Hepatol 2008;31:50-1.
9. Vernon N, Mohananey D, Ghetmiri E, Ghaffari G. Esophageal rupture as a primary manifestation in eosinophilic esophagitis. Case Rep Med 2014;2014:673189.
10. Jacobs JW, Jr., Spechler SJ. A systematic review of the risk of perforation during esophageal dilation for patients with eosinophilic esophagitis. Dig Dis Sci 2010;55:1512-5.
11. Benítez Cantero JM, Benítez Benítez Cantero JM, Angel Rey JM, Rodríguez Perálvarez M, Ayllón Terán MD, Jurado García J, Soto Escribano P, Hervás Molina AJ, Poyato González A,González Galilea A. Perforación esofágica tras biopsia en paciente con esofagitis eosinílica. Gastroenterol Hepatol 2011;34:460-3. z

Figura 1.- Desgarro mucoso producido de manera yatrogénica por el decúbito del endoscopio sobre el esófago durante la realización de la gastroscopia de un paciente con esofagitis eosinofílica.

Figura 2.- Detalle del desgarro mucosa profundo producido de manera yatrogénica en un paciente con esofagitis eosinofílica. Detalle del desgarro mucosa profundo producido de manera yatrogénica en un paciente con esofagitis eosinofílica.
Diarrea crónica en paciente con trasplante hepático: Una causa infrecuente
Diarrea crónica en paciente con trasplante hepático: Una causa infrecuente
Santos Santamarta F, Peñas Herrero I, Sánchez-Ocaña Hernández R, Santos Fernández J, De Benito Sanz M, Almohalla Alvarez C, Sánchez Antolín G, García Pajares F
Hospital Universitario Rio Hortega, Valladolid.
Trabajo Enviado: 21/12/2014
Aceptado para su publicación: 3/05/2015
RESUMEN
Paciente mujer de 68 años, trasplante hepático ortotópico en 1992 por VHC y Budd-Chiari secundario a Policitemia vera, enfermedad renal crónica avanzada. Ingresa por diarrea de un mes y medio de evolución con insuficiencia renal agudizada. El estudio de diarrea inicial de rutina es negativo, pero en una muestra de heces se identifican ooquistes de cryptosporidium spp. por lo que se inicia tratamiento con paramomicina. Mejoría del cuadro clinico con normalización de ritmo intestinal y control de heces posterior sin ooquistes al microscopio.
INTRODUCCIÓN
La diarrea es un síntoma relativamente frecuente tras el trasplante de órgano sólido. Esta puede ser un efecto secundario de diferentes fármacos, debido a causas infecciosas, diversos trastornos metabólicos o complicaciones mecánicas de la cirugía. Una correcta aproximación a la causa de la diarrea con el fin de llevar a cabo tratamiento etiológico es obligado, y debe incluir, entre otros, cultivo de heces y estudio de microorganismos causantes de diarrea en individuos inmunodeprimidos.
CASO CLÍNICO
Paciente mujer de 68 años con antecedentes personales de hepatopatía por virus C, policitemia vera, diagnosticada en 1985. Síndrome de Budd-Chiari secundario: Trasplante hepático en 1992 (VHC+Budd-Chiari) Recidiva de virus C tras trasplante, en estadio cirrótico compensado en la actualidad. Glomerulonefritis mesangiocapilar diagnosticada en 1990 con insuficiencia renal crónica progresiva (en el momento actual estadio IV, creatininas en torno a 2.2-2.5 mg/dL). En tratamiento con micofenolato-mofetilo, hidroxiurea, AAS, enalapril, furosemida, resincalcio, alopurinol y omeprazol.
La paciente ingresa en hepatología por cuadro de algo más de un mes de evolución de diarrea, con hasta 20 deposiciones al día sin productos patológicos. Acompañada de dolor abdominal difuso tipo retortijón, pérdida de peso no especificada y sensación de debilidad. La exploración física es anodina.
Entre las pruebas solicitadas presenta un hemograma normal, coagulación con TP del 86%, sodio 132, potasio 5.9, urea 223, creatinina 3.2. GOT, GPT, GGT, FA y BT normales. Gasometría venosa con pH 7.17, HCO3– 11.3, pCO2 16, lactato 2.5. PCR-CMV negativo. Toxina clostridium difficile negativa. Urocultivo y coprocultivo negativos, salvo parásitos en heces donde se observan ooquistes de criptosporidium spp. Se solicitó colonoscopia en la que se explora hasta ciego, y se aprecian abundantes divertículos con punteado petequial peridiverticular.
Al ingreso se instaura tratamiento con sueros fisiológicos y bicarbonatados y antibioterapia empírica con ciprofloxacino, mejorando la función renal y las alteraciones electrolíticas y del equilibrio ácido-base, con leve mejoría de la diarrea. Con el hallazgo de crisposporidium en heces se instaura tratamiento con paramomicina. Se mantiene con 2-5 deposiciones al día, cada vez más formadas y siempre diurnas. Al alta presenta un ritmo intestinal prácticamente normal, aunque se mantiene con paramomicina 30 días. En los dos cultivos de heces realizados el mes posterior no se identifican ooquistes.
DISCUSIÓN
Existen estudios retrospectivos de infección por cryp-tosporidium en pacientes trasplantados, pero sólo unos pocos casos de infección por cryptosporidium en pacientes trasplantados hepáticos se han publicado en la literatura 1,2. La incidencia de la infección por cryptosporidium es muy variable según el area geográfica. La transmisión puede ocurrir a partir de una persona o animal infectado, o a través de agua o alimentos conta-minados por heces y otros fluidos de un enfermo. La infección se asocia con una diarrea secretora variable en gravedad, siendo frecuente en inmunocompetentes la resolución espontánea del cuadro, mientras que en individuos inmunodeprimidos puede dar lugar a diarrea crónica, malabsorción y deshidratación, con mortalidad no desdeñable. El diagnóstico se realiza a través de la visualización de los ooquistes en heces (se recomiendan al menos tres muestras) con demostración de sus características de alcohol-resistencia, se pueden emplear varias tinciones. El método de PCR es muy sensible y específico y además permite identificar el genotipo. Los test de inmunofluorescencia directa y test de ELISA en heces también están disponibles 3. El tratamiento puede no ser necesario en inmunocompetentes salvo si los síntomas persisten. En inmunodeprimidos, el antimicrobiano de elección es nitazoxanida 500-1500 mg cada 12 horas, que debe mantenerse un mínimo de 2 semanas, aunque se recomiendan tratamientos más largos de incluso 8 semanas. Su efecto en la clínica es limitado y no está disponible en España. Otros antibióticos empleados son paramomicina o azitromicina con resultados variables 3. En ocasiones, puede resultar necesario reducir el régimen inmunosupresor 4, 5 dado el alto índice de recurrencias.
En resumen, las causas de diarrea en pacientes tras-plantados son mucho más variables, y el estudio debe incluir microorgansimos atípicos si el resto de las causas han sido descartadas.
BIBLIOGRAFÍA
1. H. Arslan, E.K. Inci et Al. Etiologic agents of diarrhea in solid organ recipients. Transplan infectious disease. 2007. 9:270-275.
2. Krause I, Amir J et Al. Cryptosporidiosis in children following solid organ transplantation. Pediatr Infect Dis J. 2012 Nov ;31(11):1135-8
3. Kotton C.N. Parasitic Infections in Solid Organ Transplan Recipients. American Journal of Transplantation 2009, 9 (Suppl 4) S234-S251.
4. Bonatti H. Barroso L.F. et Al. Cryptosporidium enteritis in solid organ transplant recipients: multicenter retrospective evaluation in 10 cases reveals an association with elevated tacrolimus concentrations. Transplant Infectious Disease. 2012. 14: 635-648
5. Frei P. Weber A. et Al. Lessons from a transplant patient with diarrhea crystosporidial infection, and possible mycophenolate-mofetil-associated colitis. Transplant Infectious Disease. 2011. 13:416-418
Neumatosis Quística Intestinal como hallazgo incidental endoscópico
Neumatosis Quística Intestinal como hallazgo incidental endoscópico
Adán Merino L1, Ponferrada Díaz A1, Fortea Ormaechea JI 2, Lozano Maya M1, Plaza Santos R1, Carrión Alonso G1., Martín Chavarri S1, Aldeguer Martínez M1
1 Servicio de Aparato Digestivo.
Hospital Universitario Infanta Leonor. Madrid
2 Servicio de Aparato Digestivo.
Hospital Universitario Marqués de Valdecilla. Santander.
Trabajo Enviado: 4/12/2014
Aceptado para su publicación: 15/04/2015
Correspondencia:
Luisa Adán Merino
Servicio de Aparato Digestivo
Hospital Infanta Leonor
Gran vía del Este 80 • 28031 – Madrid
RESUMEN
La neumatosis quística intestinal es una entidad infrecuente de etiología desconocida caracterizada por la presencia de gas en la submucosa o subserosa de la pared intestinal.
La mayoría de los pacientes están asintomáticos, pudiéndose encontrar en pruebas de imagen o endoscopicas solicitadas por otro motivo.
Puede ser causa de neumoperitoneo que no requiera tratamiento quirúrgico si no se asocia a complicaciones.
Es importante que los médicos conozcamos esta entidad para aportar el manejo más adecuado.
Palabras Clave: neumatosis quística intestinal; colon; endoscopia; tratamiento.
ABSTRACT
Pneumatosis cystoids intestinalis is an uncommon disease with an unknown etiology, characterized by the presence of gas within the submucosa or subserosa of the intestine wall.
Most of the patients are asymptomatic and may be discovered incidentally during radiographic o endoscopic examinations.
It can be a cause of non-surgical pneumoperitoneum unless there are complications
Education of the physicians is important in order to provide the most appropriate management
Keywords: pneumatosis cystoides intestinalis; colon; endoscopy; treatment
Sr. Director:
La neumatosis quística intestinal es una entidad poco frecuente que debe ser conocida por los clínicos y endoscopistas para ofrecer un adecuado manejo de esta entidad.
Presentamos el caso de una mujer de 65 años con múltiples antecedentes de interés, entre los que destacan, obesidad tipo 2, diabetes mellitus Tipo 2, hepatopatía crónica con demencia tipo Korsakoff y secuelas de poliomielitis infantil en miembros inferiores, que la condicionan un vida basal dependiente para las actividades físicas de la vida diaria, con dificultad para la movilización.
Es remitida por alteración del ritmo intestinal y antecedentes familiares de primer grado de cáncer colorrectal, por lo que se solicita una colonoscopia.
En ella, se identifica desde 60 cm de margen anal y hasta ciego, múltiples formaciones pseudopolipoideas de aspecto quístico, que se aplanan hasta prácticamente desaparecer con la toma de biopsias (Figuras 1 y 2), así como marcada diverticulosis en sigma. La histología refleja una mucosa de intestino grueso con leve inflamación crónica e hiperplasia de las criptas
Dados los hallazgos, se diagnostica de neumatosis quística intestinal con afectación colónica. Se plantea la realización de TC abdominal para completar estudio, pero dada la situación basal de la paciente, la familia y paciente deciden no continuar el estudio. Se solicita coprocultivo que es negativo y se pauta tratamiento con Rifaximina, con mejoría sintomática de la paciente.
La neumatosis quística intestinal (NQI) es una patología poco frecuente de etiología desconocida que se caracteriza por la presencia de gas dentro de la submucosa o subserosa de la pared intestinal1.
Su incidencia es difícil de determinar dado que muchos de los pacientes se encuentran asintomáticos. En series de autopsias se estima una incidencia de 3 por cada 10000 habitantes2. Puede aparecer en niños (normalmente asociados a enterocolitis necrotizante) o en el adulto, donde es más frecuente entre la quinta y la octava década.
La NQI se clasifica en primaria (15%) de etiología idiopática y secundaria (85%). En este caso se puede asociar a patología aguda grave (isquemia, perforación u obstrucción intestinal); enfermedades gastrointestinales con disrupción de la mucosa (enfermedad inflamatoria intestinal, diverticulitis, úlcera péptica); trastornos motores gastrointestinales (diabetes mellitus, esclerodermia…); enfermedades pulmonares (enfermedad pulmonar obstructiva crónica, asma, fibrosis quística); enfermedades autoinmunes o infecciosas y fármacos. También se han descrito causas iatrogénicas, como los propios procedimientos endoscópicos o su preparación3.
Se han propuesto cuatro teorías principales para explicar su patogénesis, diferentes pero no excluyentes4.
De acuerdo con la teoría mecánica, el gas disecciona la pared intestinal bien desde la cara endoluminal atravesando la mucosa o bien desde los vasos mesentéricos a través de la serosa. La teoría bacteriana defiende que las bacterias formadoras de gas acceden a la submucosa a través de defectos de mucosa o por aumento de permeabilidad de la misma. Finalmente, según la teoría bioquímica, las bacterias luminales formadoras de gas producirían un exceso de hidrógeno secundaria a la fermentación de carbohidratos que aumentaría la presión intraluminal, forzando la entrada del gas a través de la mucosa. Más discutida es la teoría pulmonar según la cual en paciente con EPOC o asma, por aumento de la presión intratorácica, se podría producir una ruptura alveolar con llegada del aire a la serosa intestinal a través del espacio perivascular y mesenterio.
La NQI puede aparecer en cualquier tramo digestivo. A diferencia de lo que se creía con anterioridad, parece ser más frecuente en colon (46%) que en intestino delgado (27%), afectando sólo en el 7% a ambas localizaciones5. Aunque puede afectar a la mucosa o subserosa, la localización más frecuente es la submucosa.
Muchos de los paciente se encuentran asintomáticos y son diagnosticados incidentalmente tras la realización de pruebas solicitadas por otros motivos. Cuando produce síntomas, los más frecuentes son diarrea, hematoquecia, dolor y distensión abdominal. Las complicaciones ocurren en el 3% de los casos e incluyen la perforación u obstrucción intestinal.
En el diagnóstico, la TC abdominal ofrece la mayor sensibilidad y ayuda a identificar si existe una causa subyacente. Los hallazgos endoscópicos incluyen quistes submucosos de superficie lisa y pálida que típicamente disminuyen o se colapsan a la toma de biopsias.
El tratamiento en estos pacientes requiere conocer dicha entidad, ya que puede ser causa de neumoperitoneo que no requiera intervención quirúrgica urgente, salvo en los casos de patología grave subyacente como en la isquemia intestinal. La presencia de abdomen agudo, acidosis metabólica, aumento de amilasa o gas en porta predicen la necesidad de cirugía6. En la mayoría de los casos es un proceso benigno autolimitado que no requiere tratamiento. En las formas secundarias el tratamiento es específico de la enfermedad de base causante.
BIBLIOGRAFÍA
1. Heng Y, Schuffler MD; Haggit RC, Rohrmann CA. Pneumatosis intestinalis: a review. Am J Gastroenterol 1995; 90: 1747-58
2. Ho LM, Paulson EK, Thompson WM. Pneumatosis intestinalis in the adult: benign to life threating causes. Am J Roentgenol 2007; 188:1604-13.
3. Khalil PN, Huber-Wagner S, Ladurner R, Kleespies A, Siebeck M, Mutschler W et al. Natural History, clinical pattern and surgical considerations of pneumatosis intestinalis. Eur J Med Res 2009; 14: 231-9.
4. Wu Li, Yang Y, Dou Y, Liu Q. A systematic analysis of pneumatoid cystoid intestinalis. World J Gastroenterol 2013; 19 (30): 4973-8.
5. Morris MS, Gee AC, Cho SD, Limbaug K, Underwood S, Ham B et al. Management and outcome of pneumatosis intestinalis. Am J Surg 2008; 195: 679-82.
6. Azzaroli F, Turco L, Ceroni L, Sartoni Galloni S, Buonfiglioli F et al. Pneumatosis cystoides intestinalis. World J Gastroenterol 2011; 17(44): 4932-6.

Figura 1.- Imagen endoscópica del aspecto de la neumatosis quís-tica intestinal.

Figura 2.- Característica retracción de los quistes con salida de gas a la toma de biopsias.
Heterotopia gástrica en esófago cervical (“inlet patch”): una entidad infradiagnosticada.
Heterotopia gástrica en esófago cervical (“inlet patch”): una entidad infradiagnosticada.
Velayos B 1, Ovelar Arribas Y 2, Fernández L 1, González JM 1
1 Servicio de Aparato Digestivo. 2 Servicio de Anatomía Patológica. Hospital Clínico de Valladolid.
Trabajo Enviado: 4/02/2015
Aceptado para su publicación: 15/04/2015
Correspondencia:
Benito Velayos Jiménez
Servicio de Aparato Digestivo.
Hospital Clínico de Valladolid
Av Ramón y Cajal 3 • 05003 Valladolid
Tfno.: 983420000 ext 86270 • Fax: 983257511
benitovelayos@hotmail.com
Sr director:
Presentamos el caso de un varón de 60 años sin antecedentes de interés, que consulta por ardor y regurgitación de larga evolución. El paciente no había sido estudiado ni tratado al respecto previamente.
La gastroscopia mostró dos erosiones de aspecto péptico en esófago distal y un área plana de eritema de 1,5 cm con bordes bien delimitados, situada a 20 cm de la arcada dentaria, inmediatamente distal a la boca de Killian (Figura 1).
Las muestras histológicas fueron informadas como mucosa gástrica sin datos de displasia ni Helicobacter pylori (Figura 2).
DISCUSIÓN
La heterotopia gástrica en esófago cervical (conocida como “inlet patch”) consiste en la presencia de mucosa gástrica, generalmente células oxínticas, en los primeros centímetros por debajo del esfínter esofágico superior.
Su patogenia es discutida, si bien se le presupone un origen congénito o en relación al reflujo gastroesofágico (1).
Es más frecuente en varones y se ha descrito en el 1-18% de las gastroscopias (2), aunque su prevalencia llegaría hasta el 70 % en los estudios de necropsias (3). Se estima que es a menudo no diagnosticada durante las pruebas endoscópicas por un examen negligente o demasiado rápido de la zona donde asienta (2).
Rara vez causa síntomas, si bien se ha asociado a esófago de Barrett y adenocarcinoma (4, 5).
El tratamiento de la heterotopia gástrica mediante ablación asociada a tratamiento con inhibidores de la bomba de protones sólo se requiere cuando se presentan complicaciones (6). No existe consenso sobre recomendaciones de seguimiento endoscópico en los casos de hallazgo incidental (2).
El caso presentado ilustra que el difícil acceso y visualización del esófago cervical y la mayor frecuencia de lesiones relevantes en tramos más distales, no deberían justificar el no realizar una exploración detenida de esta localización anatómica.
BIBLIOGRAFÍA
1. Rosztóczy A, Izbéki F, Németh IB, et al. Detailed esophageal function and morphological analysis shows high prevalence of gastroesophageal reflux disease and Barrett`s esophagus in patients with cervical inlet patch. Diseases of the Esophagus 2012; 25: 498-504.
2. Chong VH. Clinical significance of heterotopic gastric mucosal patch of the proximal esophagus. World J Gastroenterol 2013; 19 (3): 331-38.
3. von Rahden BH, Stein HJ, Becker K, et al. Heterotopic gastric mucosa of the esophagus: literature-review and proposal of a clinicopathologic classification. Am J Gastroenterol 2004; 99: 543-51.
4. Yuksel I, Uskudar O, Koklu S, et al. Inlet patch: associations with endoscopic findings in the upper gastrointestinal system. Scand J Gastroenterol 2008; 43 (8): 910-4.
5. Neumann WL, Luján GM, Genta RM. Gastric heterotopia in the proximal oesophagus (“inlet patch”): Association with adenocarcinomas arising in Barrett mucosa. Digestive and Liver Disease 2012; 44: 292-6.
6. Bajbouj M, Becker V, Eckel F, et al. Argon plasma coagulation of cervical heterotopic gastric mucosa as an alternative treatment for globus sensations. Gastroenterology 2009; 137(2):440-4.


Fístula Colecisto-Duodenal con cálculo con tránsito
Fístula Colecisto-Duodenal con cálculo con tránsito
Colmenarejo García E, Delgado Valdueza J, Valdés de Anca A, Martín Pérez E
Servicio de Cirugía General y Digestivo. Hospital Universitario de La Princesa, Madrid. España.
Trabajo Enviado: 28/12/2014
Aceptado para su publicación: 15/04/2015
Correspondencia:
Email: ecolmenarejo3@gmail.com
Mujer de 89 años, sin antecedentes de interés que acude a Urgencias por cuadro de vómitos alimenticios con intolerancia oral y tránsito positivo, sin otra sintomatología asociada. Exploración física sin alteraciones y en radiografía de abdomen simple importante dilatación de cámara gástrica. Se realiza tomografía computarizada abdominal apreciándose fístula colecistoduodenal con cálculo de gran tamaño en tránsito (Figuras 1 y 2). Ante la presencia de un síndrome de Bouveret y la no resolución del cuadro de vómitos, se decide intervención quirúrgica, realizándose colecistectomía, fistulectomía y sutura primaria del orificio fistuloso de 1 cm en duodeno, con extracción de cálculos. Evolución postoperatoria favorable y alta el 10º día postoperatorio.

Figura 1.-

Figura 2.-
Anuncio de la XXXVIII reunión anual de la ACAD
Anuncio de la XXXVIII reunión anual de la ACAD

Sede de la Reunión:
Hospedería Fonseca, Universidad de Salamanca
C/ Fonseca, 2 – 37002 Salamanca
Organiza y convoca:
Dr. Antonio Rodríguez
Servicio de Digestivo
Hospital Clínico Universitario de Salamanca
Secretaría, patrocinios y reserva de espacios
Dime y Diras Comunicación
C/ Nochebuena, 4 – 47011 Valladolid
Tlf: 983 205 917
Email: dimeyduras@dimeydiras.com