Diarrea crónica en paciente con trasplante hepático: Una causa infrecuente
Santos Santamarta F, Peñas Herrero I, Sánchez-Ocaña Hernández R, Santos Fernández J, De Benito Sanz M, Almohalla Alvarez C, Sánchez Antolín G, García Pajares F
Hospital Universitario Rio Hortega, Valladolid.
Trabajo Enviado: 21/12/2014
Aceptado para su publicación: 3/05/2015
RESUMEN
Paciente mujer de 68 años, trasplante hepático ortotópico en 1992 por VHC y Budd-Chiari secundario a Policitemia vera, enfermedad renal crónica avanzada. Ingresa por diarrea de un mes y medio de evolución con insuficiencia renal agudizada. El estudio de diarrea inicial de rutina es negativo, pero en una muestra de heces se identifican ooquistes de cryptosporidium spp. por lo que se inicia tratamiento con paramomicina. Mejoría del cuadro clinico con normalización de ritmo intestinal y control de heces posterior sin ooquistes al microscopio.
INTRODUCCIÓN
La diarrea es un síntoma relativamente frecuente tras el trasplante de órgano sólido. Esta puede ser un efecto secundario de diferentes fármacos, debido a causas infecciosas, diversos trastornos metabólicos o complicaciones mecánicas de la cirugía. Una correcta aproximación a la causa de la diarrea con el fin de llevar a cabo tratamiento etiológico es obligado, y debe incluir, entre otros, cultivo de heces y estudio de microorganismos causantes de diarrea en individuos inmunodeprimidos.
CASO CLÍNICO
Paciente mujer de 68 años con antecedentes personales de hepatopatía por virus C, policitemia vera, diagnosticada en 1985. Síndrome de Budd-Chiari secundario: Trasplante hepático en 1992 (VHC+Budd-Chiari) Recidiva de virus C tras trasplante, en estadio cirrótico compensado en la actualidad. Glomerulonefritis mesangiocapilar diagnosticada en 1990 con insuficiencia renal crónica progresiva (en el momento actual estadio IV, creatininas en torno a 2.2-2.5 mg/dL). En tratamiento con micofenolato-mofetilo, hidroxiurea, AAS, enalapril, furosemida, resincalcio, alopurinol y omeprazol.
La paciente ingresa en hepatología por cuadro de algo más de un mes de evolución de diarrea, con hasta 20 deposiciones al día sin productos patológicos. Acompañada de dolor abdominal difuso tipo retortijón, pérdida de peso no especificada y sensación de debilidad. La exploración física es anodina.
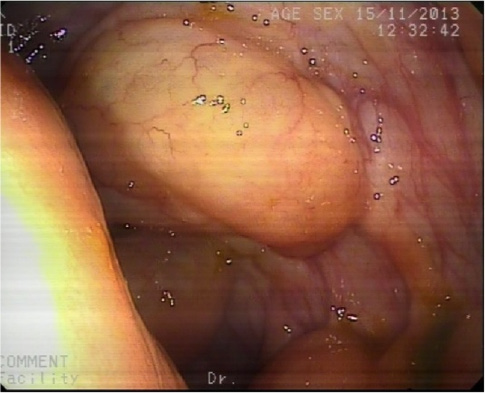
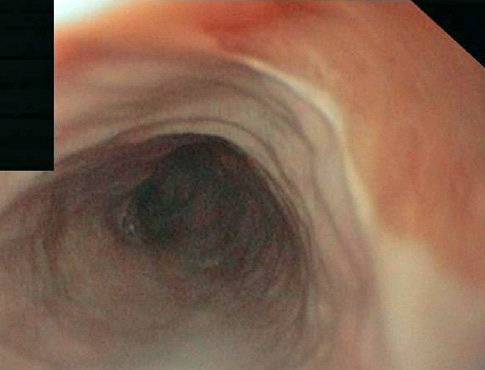
Entre las pruebas solicitadas presenta un hemograma normal, coagulación con TP del 86%, sodio 132, potasio 5.9, urea 223, creatinina 3.2. GOT, GPT, GGT, FA y BT normales. Gasometría venosa con pH 7.17, HCO3– 11.3, pCO2 16, lactato 2.5. PCR-CMV negativo. Toxina clostridium difficile negativa. Urocultivo y coprocultivo negativos, salvo parásitos en heces donde se observan ooquistes de criptosporidium spp. Se solicitó colonoscopia en la que se explora hasta ciego, y se aprecian abundantes divertículos con punteado petequial peridiverticular.
Al ingreso se instaura tratamiento con sueros fisiológicos y bicarbonatados y antibioterapia empírica con ciprofloxacino, mejorando la función renal y las alteraciones electrolíticas y del equilibrio ácido-base, con leve mejoría de la diarrea. Con el hallazgo de crisposporidium en heces se instaura tratamiento con paramomicina. Se mantiene con 2-5 deposiciones al día, cada vez más formadas y siempre diurnas. Al alta presenta un ritmo intestinal prácticamente normal, aunque se mantiene con paramomicina 30 días. En los dos cultivos de heces realizados el mes posterior no se identifican ooquistes.
DISCUSIÓN
Existen estudios retrospectivos de infección por cryp-tosporidium en pacientes trasplantados, pero sólo unos pocos casos de infección por cryptosporidium en pacientes trasplantados hepáticos se han publicado en la literatura 1,2. La incidencia de la infección por cryptosporidium es muy variable según el area geográfica. La transmisión puede ocurrir a partir de una persona o animal infectado, o a través de agua o alimentos conta-minados por heces y otros fluidos de un enfermo. La infección se asocia con una diarrea secretora variable en gravedad, siendo frecuente en inmunocompetentes la resolución espontánea del cuadro, mientras que en individuos inmunodeprimidos puede dar lugar a diarrea crónica, malabsorción y deshidratación, con mortalidad no desdeñable. El diagnóstico se realiza a través de la visualización de los ooquistes en heces (se recomiendan al menos tres muestras) con demostración de sus características de alcohol-resistencia, se pueden emplear varias tinciones. El método de PCR es muy sensible y específico y además permite identificar el genotipo. Los test de inmunofluorescencia directa y test de ELISA en heces también están disponibles 3. El tratamiento puede no ser necesario en inmunocompetentes salvo si los síntomas persisten. En inmunodeprimidos, el antimicrobiano de elección es nitazoxanida 500-1500 mg cada 12 horas, que debe mantenerse un mínimo de 2 semanas, aunque se recomiendan tratamientos más largos de incluso 8 semanas. Su efecto en la clínica es limitado y no está disponible en España. Otros antibióticos empleados son paramomicina o azitromicina con resultados variables 3. En ocasiones, puede resultar necesario reducir el régimen inmunosupresor 4, 5 dado el alto índice de recurrencias.
En resumen, las causas de diarrea en pacientes tras-plantados son mucho más variables, y el estudio debe incluir microorgansimos atípicos si el resto de las causas han sido descartadas.
BIBLIOGRAFÍA
1. H. Arslan, E.K. Inci et Al. Etiologic agents of diarrhea in solid organ recipients. Transplan infectious disease. 2007. 9:270-275.
2. Krause I, Amir J et Al. Cryptosporidiosis in children following solid organ transplantation. Pediatr Infect Dis J. 2012 Nov ;31(11):1135-8
3. Kotton C.N. Parasitic Infections in Solid Organ Transplan Recipients. American Journal of Transplantation 2009, 9 (Suppl 4) S234-S251.
4. Bonatti H. Barroso L.F. et Al. Cryptosporidium enteritis in solid organ transplant recipients: multicenter retrospective evaluation in 10 cases reveals an association with elevated tacrolimus concentrations. Transplant Infectious Disease. 2012. 14: 635-648
5. Frei P. Weber A. et Al. Lessons from a transplant patient with diarrhea crystosporidial infection, and possible mycophenolate-mofetil-associated colitis. Transplant Infectious Disease. 2011. 13:416-418