Absceso hepático piógeno por Clostridium y Bacteroides, con evolución favorable tras drenaje y antibióticos.
Marcos Sánchez F, de Matías Salces L, Blanco Jarava A, Yzusqui Mendoza M, Vizuete Calero A y Gallegos Polonio A
Servicio de Medicina Interna del Hospital Nª Sª del Prado de Talavera de la Reina. (Toledo).
CORRESPONDENCIA:
Fernando Marcos Sánchez
c/ Gregorio Corrochano nº1 • 45600 Talavera de la Reina
fmarcos666@yahoo.es
RESUMEN
Presentamos el caso de una paciente de 79 años, con antecedentes de diabetes mellitus e infecciones urinarias de repetición. Tras un cuadro solapado presentó en los tres días previos un cuadro de fiebre elevada de hasta 39ºC, acompañado de escalofríos y sudoración con leve dolor abdominal En la exploración existía hipotensión arterial que mejoró con aporte de volumen. En la analítica se observaba leucocitosis con desviación a la izquierda, deterioro de la función renal, elevación de las transaminasas y de la PCR. En una TAC abdominal se aprecio una imagen compatible con absceso abdominal de 4 x 3,6 centímetros. En hemocultivos se aisló Clostridium clostridioform y el drenaje del absceso fue positivo a Bacteroides thetaiotaomicron y Bacteroides ovatus. Recibió tratamiento antimicrobiano de modo prolongado, efectuándose asimismo drenaje del absceso con aguja. La evolución fue finalmente favorable. Posteriormente se comentan diversos aspectos etiológicos, clínicos, diagnósticos, pronósticos y terapéuticos del absceso hepático piógeno.
PALABRAS CLAVES: absceso hepático piógeno, drenaje con aguja, Clostridium y Bacteroides.
Introducción
El absceso hepático bacteriano (piógeno) se debe a una infección polimicrobiana por gérmenes aerobios gram negativos y anaerobios gram positivos. Escherichia coli se aisla en las dos terceras partes, seguida en frecuencia por el S. faecalis, Klebsiella pneumoniae y Proteus. También se pueden aislar estafilococos, especialmente en pacientes que han recibido quimioterapia y con mucha menor frecuencia se aíslan anaerobios gram positivos como Bacteroides sp, Actinomyces sp, Fusobac-terium sp y Clostridium (1-4).
Se trata de una infección poco frecuente en la actualidad. La edad de presentación oscila entre los 40 y los 60 años, existiendo una mayor predilección por el sexo femenino.
La vía de diseminación predominante es la biliar (40% de los casos), seguida de la portal (25%), idiopáticos (20%), fundamentalmente en diabéticos y por contigüidad, postquirúrgicos o post-traumáticos y también por la vía hemática.
La presentación clínica en la actualidad es menos aguda que hace años, así suelen presentar dolor sordo, malestar general, febrícula y pérdida de peso, aunque en ocasiones se observa fiebre en picos, dolor en el cuadrante superior derecho y shock séptico, que es el modo de presentación que se observaba hace años.
Por su rareza, nos parece interesante presentar un nuevo caso de absceso hepático de evolución inicialmente solapada, hasta pocos días antes del ingreso en que presentó un cuadro de fiebre en picos asociado a hipotensión severa. Se aislaron en sangre y en el drenaje del absceso Clostridium y Bacteroides. La evolución fue lentamente favorable, sin precisar tratamiento quirúrgico, realizándose tratamiento antibiótico prolongado y dos drenajes del absceso,
Caso Clínico
Mujer de 79 años de edad, con antecedentes personales de hipertensión arterial en tratamiento con irbesartan, diabetes mellitus en tratamiento con metformina, infecciones urinarias de repetición. En los últimos meses había recibido tratamiento con diversos antibióticos por presuntas infecciones urinarias de repetición, sin confirmación microbiológica Tres días antes del ingreso presentó fiebre elevada de hasta 39ºC, escalofríos e intensa sudoración, dolor abdominal ocasional, no náuseas ni alteración del ritmo intestinal.
A la exploración: T.A: 80/50 mmHg, 125 latidos por minuto, 39,3ºC, taquipneica, palidez de piel. Consciente, orientada. A. Cardiaca: tonos rítmicos, rápidos, sin soplos. A. Pulmonar: disminución del murmullo vesicular basal bilateral. Abdomen: blando, depresible, globuloso, doloroso a la palpación de modo difuso, sin contractura, dudosa puño percusión renal derecha. Leves edemas maleolares.
Laboratorio. Hemograma: 13.600 leucocitos con desviación a la izquierda, hemoglobina de 9 gramos/dl, 75.000 plaquetas. En la bioquímica destacó: creatinina de 2,2 miligramos/dl, glucosa de 238 miligramos/dl, urea de 98 miligramos/dl, LDH: 761 U/L; ALT de 59 U/L, AST de 63 U/L, PCR de 245 miligramos/L, orina elemental: 1-5 hematíes y leucocitos aislados. Gasometría arterial: pH: 7,43; pO2: 69mmHg, pCO2: 32mmHg, CO3H: 21,2 mmol/l. Urocultivos negativos.
R.X. Tórax: no cardiomegalia, campos pulmonares claros.
ECG: taquicardia sinusal, sin alteraciones relevantes de la repolarización ventricular.
Ecografía renal al ingreso: no litiasis ni dilatación del sistema excretor renal.
Ecocardiograma: ventrículo izquierdo hipertrófico, no dilatado, fracción de eyección del ventrículo izquierdo conservada, no signos de hipertensión pulmonar, no derrame pericárdico.
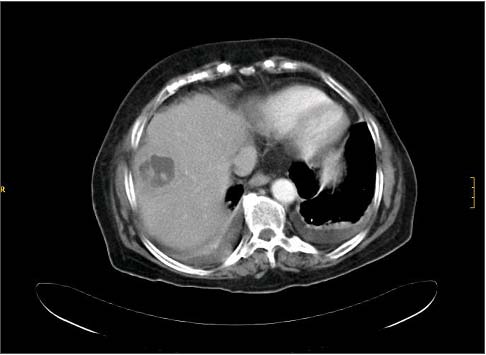
TAC abdominal: lesión ocupante de espacio hepática de 4,1 x 3,6 centímetros, periférica, localizada en segmentos V–VIII del lóbulo hepático derecho, hipodensa, con pared gruesa e irregular y con captación periférica, sugiere absceso hepático. Vía biliar, páncreas, bazo, suprarrenales y riñones normales, no líquido libre. (Figura 1). Se realizó asimismo una resonancia magnética hepática y una colangiorresonancia sin nuevos hallazgos.
Posteriormente se realizó por parte del Servicio de Radiología intervensionista del Hospital Virgen de la Salud de Toledo, la punción del absceso, obteniéndose material purulento, dejándose un drenaje. En los siguientes días fue preciso colocar un nuevo drenaje. Se recibieron hemocultivos positivos para Clostridium clostridioform, resistente a la penicilina y a la clindamicina, pero muy sensible al metronidazol, imipenem y menos a amoxicilina/ácido clavulánico. El cultivo del material drenado del absceso fue positivo a Bacteroides thetaiotaomicron y Bacteroides ovatus, con un perfil de sensibilidad y resistencia muy similares al anterior resultado.

FIGURA 1.-Lesión ocupante hepática de 4,1 x 3,6 centímetros, periférica, en el segmento V-III, hipodensa, con pared densa e irregular y con captación periférica.

FIGURA 2.-Lesión hipodensa hepática de 1 centímetro de diámetro. 75.000
En su evolución presentó un derrame pleural derecho, con características de exudado, sin crecimiento bacteriano, asimismo presentó varios episodios de retención urinaria y la diabetes mellitus se descompensó severamente. Fue politransfundida. El deterioro de la función renal que presentaba inicialmente se resolvió totalmente, así como las alteraciones en la bioquímica hepática. Fue tratada con diversos antibióticos levofloxacino, clindamicina y posteriormente según el resultado de los cultivos con metronidazol.
La evolución fue lentamente favorable, nuevos controles con TAC demostraron disminución progresiva del tamaño del absceso, por lo que no se realizó intervención quirúrgica, procediéndose finalmente al alta tras 30 días de hospitalización. A los 3 meses en una nuevo TAC abdominal se observaba una lesión hipodensa hepática de 1 centímetro de diámetro (Figura 2). No volvió a presentar fiebre. Fue dada de alta de consultas a los 6 meses del episodio inicial.
Discusión
Las alteraciones analíticas que se encuentran en los pacientes con abscesos hepáticos son inespecíficas, observándose leucocitosis con desviación a la izquierda, anemia, elevación de la analítica hepática de transaminasas y fosfatasa alcalina y franca elevación de la PCR. El diagnóstico por imagen se consigue mediante la realización de una ecografía abdominal, tomografía axial computarizada abdominal y resonancia magnética hepática, pero pueden no ser específicas, debiendo realizar el diagnóstico diferencial con hematomas, tumor necrótico, quistes hemorrágicos, quiste hidatídico complicado, metástasis única (1,4).
Debe realizarse un tratamiento antibiótico adecuado prolongado, teniendo en cuenta la sensibilidad del microorganismo, pero además la mayoría requieren la realización de drenaje mediante aguja, dado que además de confirmar el diagnóstico permite extraer la máxima cantidad posible de pus para retraer la cápsula y favorecer la mejor penetración de los antibióticos (5,6). Actual-mente la mortalidad es inferior al 16%. El pronóstico empeora con el retraso en el diagnóstico, fiebre continuada, infecciones polimicrobianas demostradas por hemocultivos, enfermedades asociadas, derrame pleural, hipoalbuminemia y edad avanzada.
Destacamos que nuestra paciente pese a presentar la mayoría de estos factores la evolución fue finalmente favorable sin precisar tratamiento quirúrgico. También son altamente infrecuentes los aislamientos microbiológicos de Bacteroides y Clostridium, sin ningún organismo gramnegativo, como suele ser habitual.
BIBLIOGRAFÍA
- Alarcón Del Agua I, Flores Cortés M, Pareja Ciuró F, Puppo Moreno A, Jiménez Rodríguez R. Absceso hepático por Clostridium perfringens abierto espontáneamente a la cavidad abdominal. Cir Esp 2009; 85:187-9.
- Kreidl KO, Green GR, Wren SM. Intravascular hemolysis from a Clostridium perfringens liver abscess. J Am Coll Surg 2002; 194:387.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Hepatic abscess: changes in etiology, diagnosis and management. Ann Surg 1990; 212: 655-62.
- Barajas Martínez JM, Vicente Gutiérrez M, Rivera Vaquerizo P, García García V, Herrero Quiros C, Loeches Prado N, et al. Absceso hepático primario causado por Actinomyces meyeri. Rev Esp Enferm Dig 2002; 94:108-9.
- Ch Yu S, Hg Lo R, Kan PS, Metreweli C. Pyogenic liver abscess: Treatment with needle aspiration. Clin Radiol 1997; 52: 912-6.
- Khan R, Hamid S, Abrid S, Jafri W, Abbas Z, Islam M, et al. Predictive factors for early aspiration in liver abscess. Word J Gastroenterol 2008;14:2089-93.