Foco de criptas aberrantes: la semilla del cáncer de colon
J Rodríguez-Sánchez 1, F Luna Hita 1, T Luque Núñez 1, MT Martínez Torres 1, P Reales Figueroa 1,2, M Salas Cabañas 2, R. Sotillo 3, A Carazo Marín 1,2
(1) Unidad de Endoscopia. (2) Servicio de Medicina Interna. (3) Servicio de Anatomía Patológica. Hospital Gutiérrez Ortega de Valdepeñas. Ciudad Real.
CORRESPONDENCIA:
Joaquín Rodríguez-Sánchez
Unidad de Endoscopia.
Hospital Gutiérrez Ortega de Valdepeñas.
Av. Estudiantes s/n
Teléfono: 926320200-ext.20406.
E-mail: jjrs40@sescam.jccm.es
RESUMEN
Los focos de criptas aberrantes son lesiones caracterizadas como agregados crípticos con patrón distorsionado, rodeados de mucosa colónica normal. Fueron descritos por primera vez en ratas, tras la administración de un agente carcinogénico (azoxymetano). La primera descripción en humanos se realizó en 1991, y desde entonces son múltiples los estudios que postulan su papel como lesión precursora de cáncer colorrectal, identificando en sus células mutaciones genéticas en K-RAS hasta en un 95% de los casos. El estudio de estas lesiones se realiza fundamentalmente sobre la mucosa de recto y sigma, mediante técnica de cromoendoscopia utilizando una solución de azul de metileno al 0,25%, combinado con endoscopios de alta definición, o bien con endoscopios convencionales usando índigo carmín. La detección de este tipo de lesiones, supone una herramienta útil en la estratificación de riesgo de cáncer colorrectal en población de screening. Presentamos el caso de un varón de 67 años, que se sometió una colonoscopia por estudio de diarrea crónica, detectando tras la realización de cromoendoscopia con Índigo carmín al 0,5% y exploración con alta definición a x1,5 aumentos varios focos de criptas aberrantes en las cercanías de un adenoma tubular sin displasia resecado en ciego. Las biopsias, fueron informadas como focos de criptas con transformación hiperplásica. Conclusión: los focos de criptas aberrantes suponen un cambio precoz de la mucosa colónica en el proceso de desarrollo de CCR. La detección in vivo de estas lesiones nos permite evaluar población de alto riesgo en estadios precoces de la enfermedad.
Palabras clave: focos de criptas aberrantes, cáncer colorrectal, cromoendoscopia, cribado.
ABSTRACT
Aberrant crypt foci are cryptic lesions characterized as aggregates with distorted pattern, surrounded by normal colonic mucosa. They were first described in rats after dministration of a carcinogen (azoxymethane). The first description in humans was performed in 1991, and since then many studies are postulated its role as a precursor lesion of colorectal cancer, identifying genetic mutations in their cells in K-RAS up to 95% of cases. The study of these lesions is done primarily on the mucosa of the rectum and sigmoid by chromoendoscopy technique using a methylene blue solution 0.25%, coupled with high-definition endoscopes, or with conventional endoscopes using indigocarmine. The detection of this type of injury, is a useful tool in risk stratification of colorectal cancer screening population. We report the case of a man aged 67, who underwent a colonoscopy for chronic diarrhea study, detecting after performing with Indigo carmine chromoendoscopy 0,5% solution and high definition x1.5 zoom, multiple aberrant crypt foci in vicinity of a tubular adenoma without dysplasia resected in cecum. Biopsies were reported as crypt foci with hyperplastic transformation. Conclusion: the aberrant crypt foci represent an early change in the colonic mucosa of CRC development process. The detection of these lesions in vivo allows us to evaluate high-risk population, in early stages of the disease.
Keywords: aberrant crypt foci, colorectal cancer, chromoendos-copy, screening.
INTRODUCCIÓN
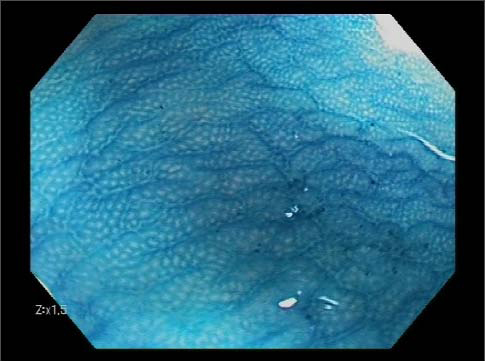
Los focos de criptas aberrantes (FCA), descritos por Bird y cols. (1) como lesiones halladas en la mucosa colónica de ratas expuestas a un agente carcinogénico (azoxymetano), consisten en agregados de criptas aumentadas de tamaño y rodeadas por mucosa normal la cual presenta un patrón homogéneo al teñirla con azul de metileno al 0,25% (Figura 1), aunque puede utilizarse otros colorantes como el índigo carmín.
También en modelo murino, se observó como a medida que aumentaba el tiempo de exposición al agente carcinogénico, se producía un incremento en su tamaño apareciendo mayor atipia nuclear, y por tanto mayor grado de displasia (2), hecho que puso de manifiesto su papel como precursor de cáncer colorrectal (CCR). En humanos, fue descrito por primera vez por Roncucci y cols.(3) en 1991, demostrando como la densidad por cm2 de FCA era mayor en especímenes de colectomía de pacientes con poliposis adenomatosa familiar, que aquellos con cáncer de colon y enfermedad inflamatoria intestinal. Posteriormente, los FCA fueron visualizados in vivo usando técnicas de cromoendoscopia de magnificación (4, 5) (Figura 1) e incluso con endoscopia convencional (6).

FIGURA 1.-Patrón de criptas normal (tinción de Azul de Metileno al 0,25% explorado con zoom x1,5 y realce A5). Se aprecia un patrón regular de líneas epiteliales dentro de la normalidad con luces redondeadas y homogéneas.
OBSERVACIÓN CLÍNICA
Se presentan dos casos donde mediante realización de cromoendoscopía de magnificación con colonoscopio CF-H180AL con sistema EVIS EXERA-II (Olympus. Hamburgo. Alemania), se exploró la existencia de FCA.
Ambos pacientes fueron preparados con solución de polietilenglicol disuelto en un volumen de 2 litros de agua, añadiendo 2 litros adicionales. Los dos pacientes presentaron una limpieza óptima del colon catalogada como grado 3 según la Boston Bowel Preparation Scale (BBPS) (7).
El primer caso trata de un paciente de 67 años de edad al que se le indicó la exploración por diarrea crónica. En ciego se observó una lesión polipoidea (0-Is según la clasificación de París) de 6 mm de tamaño que fue teñida con solución de Índigo Carmín al 0,5% visualizando un Pit Pattern IIIL de Kudo, y resecada con técnica de polipectomía estándar. La pieza fue informada posteriormente como adenoma tubular sin focos de displasia.
Al teñir las proximidades de la lesión, observamos varias formaciones mucosas bien definidas, discretamente sobreelevadas de 1 mm de diámetro, que al visualizarse con realce de imagen A5 y zoom x1,5 (70 aumentos), se presentan como agregados de criptas aumentadas de tamaño, que se tiñen de forma más intensa objetivando una línea epitelial más gruesa y una luz redondeada y comprimida (Figura 2). Se tomaron biopsias con fórceps convencionales y las muestras fueron fijadas en Formol y posteriormente incluidas en parafina, realizándose cortes seriados de 3 a 5 m para ser teñidos con hematoxilina eosina y visualizados al microscopio óptico. Las muestras fueron informadas como mucosa colónica con focos de tejido hiperplásico, sin evidencias de transformación adenomatosa ni displasia.
El segundo caso trata de una paciente de 79 años que se realizó una colonoscopia para control de pólipos adenomatosos menores de 5 mm sin displasia resecados 3 años antes.
En la exploración apreciamos una lesión 0-Isp de París de 1,5 cm de tamaño Pit Pattern III-L de Kudo mediante visualización con sistema Narrow Band Imaging (NBI), se lleva a cabo resección endoscópica mucosa en Bloque sin incidencias. La histología de la lesión fue informada como adenoma túbulo-velloso con focos de displasia leve. En retirada procedemos a realizar cromoendoscopia con Azul de Metileno al 0,25% en los últimos 15 cm de ampolla rectal, aplicando la solución con ayuda de catéter Spray (PW-5L-1. Olympus. Hamburgo. Alemania). Previamente a la tinción, lavamos con solución de N-Acetil Cisteina al 10%.

FIGURA 2.-Caso 1. Foco de criptas aberrantes detectado en elpolo cecal. (Tinción de Índigo Carmín al 0,5% exploración con zoom x1,5 y realce A5). Se aprecia un agregado de más de 20 criptas con engrosamiento de la línea epitelial y luz redondeada regular, lo cual sugiere su estirpe hiperplásica. de displasia
Explorando toda la superficie mucosa del recto con realce A5 y zoom x1,5 (70 aumentos), apreciamos hasta 8 focos de criptas aberrantes, todos ellos con luces en herradura y líneas epiteliales engrosadas. Tomamos biopsias de aquellos de mayor tamaño, que son informadas como focos de tejido hiperplásico sin evidencia de transformación displásica (Figura 3).

FIGURA 3.-Caso 2. Focos de criptas aberrantes detectados en recto (tinción de azul de metileno al 0,25%. Exploración con zoom x1,5 y realce A5). Se aprecian agregados de criptas (>20) con luces redondeadas y en herradura, y líneas epiteliales engrosadas sugiriendo tejido hiperplásico. Claramente se produce una diferenciación de tejido al compararlo con la mucosa circundante.
DISCUSIÓN
Desde la primera descripción de los FCA in vivo (4), son varios los estudios que han puesto de manifiesto su estrecha relación con el desarrollo de CCR y adenomas colorrectales, demostrando incluso, la presencia en su genoma de mutaciones en el gen K-RAS (8, 9). Al igual que nuestro segundo caso, la mayoría de los estudios se han realizado sobre colon izquierdo y recto, ya que técnicamente la exploración es menos dificultosa por la buena tolerancia del paciente y la ausencia de pliegues colónicos acusados, que unido a la mayor densidad de FCA en estos tramos, hace que la exploración a este nivel sea más rentable, prolongando el tiempo de colonoscopia en apenas 10-15 minutos (10, 11) (tiempo aproximado empleado en ambos casos).
En el primer caso que presentamos, los FCA se detectaron en el polo cecal, lo cual ocurre en torno al 30% de los casos sin haberse estudiado tan ampliamente el papel que los FCA de esta localización juegan en la carcinogénesis del CCR (10). Un estudio realizado sobre población japonesa (12) con un amplio número de pacientes (n=370), detectó FCA en recto en el 55% de pacientes con colonoscopia normal, con una media de 1 FCA por paciente, encontrando displasia hasta en un 10% de ellos. La prevalencia de FCA se incrementaba hasta el 90% en pacientes con adenomas colorrectales, presentando displasia hasta en el 15% de los casos. Es este estudio, el 100% de los individuos con CCR presentaban FCA con datos de displasia hasta en el 50%. Más recientemente se ha demostrado como la densidad de FCA en recto es mayor en pacientes con historia familiar de CCR (13). Sin embargo Kim y cols. (14) examinaron de forma prospectiva 802 pacientes sin encontrar correlación entre el número de FCA en colon izquierdo y la presencia de adenomas. A pesar de ello, en un subanálisis se encontró una correlación significativa entre la existencia de FCA pequeños (<20 criptas) y la tasa de detección de adenomas. Recientemente Uchiyama y cols. (15) han encontrado una correlación entre el número de FCA detectados tras la realización de polipectomía endoscópica y la tasa de recurrencia de adenomas. En un reciente estudio (16), realizado sobre 89 pacientes, se observó como el tamaño de los adenomas se correlacionó con el número de FCA detectados en una endoscopia índice realizada un año antes. Los autores concluyen que el número de FCA puede ser un factor predictor en la incidencia de adenomas de gran tamaño. Se han descrito varios criterios endoscópicos para clasificar los FCA: número de criptas, morfología de la luz, tamaño y grosor del epitelio; sin embargo, el grado de correlación interobservador es muy bajo, excepto para el número de criptas (k=0,21- 0,49), por lo tanto, ningún criterio endoscópico es útil para predecir el tipo histológico y el grado de displasia (17), lo cual hace que hasta la fecha sea necesaria la toma de biopsias.
En conclusión, podemos decir que los FCA suponen un cambio precoz de la mucosa colónica en el proceso de desarrollo de CCR. Es un hecho frecuente que en la práctica clínica pasen desapercibidos, dado el escaso uso de tinciones de forma rutinaria. El desarrollo de la endoscopia de magnificación y las técnicas de cromoendoscopia, suponen un paso clave en el diagnóstico de estas lesiones, permitiéndonos su detección in vivo lo que hace posible evaluar población de alto riesgo en los estadios precoces de la enfermedad. De este modo, en un futuro a corto plazo, la detección de FCA puede ser utilizada como herramienta para “subestratificar” poblaciones de alto riesgo, a las que aplicar seguimientos más estrechos, o incluso tratamientos orientados a la prevención primaria del CCR.
BIBLIOGRAFÍA
- Bird RP. Observation and quantification of aberrant crypts in the murine colon treated with a colon carcinogen: preliminary findings. Cancer Lett 1987 Oct 30;37(2):147-51.
- McLellan EA, Medline A, Bird RP. Sequential analyses of the growth and morphological characteristics of aberrant crypt foci: putative preneoplastic lesions. Cancer Res 1991 Oct 1;51(19):5270-4.
- Roncucci L, Stamp D, Medline A, Cullen JB, Bruce WR. Identification and quantification of aberrant crypt foci and microadenomas in the human colon. Hum Pathol 1991 Mar;22(3):287-94.
- Konstantakos AK, Siu IM, Pretlow TG, Stellato TA, Pretlow TP. Human aberrant crypt foci with carcinoma in situ from a patient with sporadic colon cancer. Gastroenterology 1996 Sep;111(3):772-7.
- Yokota T, Sugano K, Kondo H, Saito D, Sugihara K, Fukayama N, et al. Detection of aberrant crypt foci by magnifying colonoscopy. Gastrointest Endosc 1997 Jul;46(1):61-5.
- Seike K, Koda K, Oda K, Kosugi C, Shimizu K, Nishimura M, et al. Assessment of rectal aberrant crypt foci by standard chromoscopy and its predictive value for colonic advanced neoplasms. Am J Gastroenterol 2006 Jun;101(6):1362-9.
- Calderwood AH, Jacobson BC. Comprehensive validation of the Boston Bowel Preparation Scale. Gastrointest Endosc 2010 Oct;72(4):686-92.
- Roncucci L, Modica S, Pedroni M, Tamassia MG, Ghidoni M, Losi L, et al. Aberrant crypt foci in patients with colorectal cancer. Br J Cancer 1998 Jun;77(12):2343-8.
- Yamashita N, Minamoto T, Ochiai A, Onda M, Esumi H. Frequent and characteristic K-ras activation and absence of p53 protein accumulation in aberrant crypt foci of the colon. Gastroenterology 1995 Feb;108(2):434-40.
- Hurlstone DP, Cross SS. Role of aberrant crypt foci detected using high-magnification-chromoscopic colonoscopy in human colorectal carcinogenesis. J Gastroenterol Hepatol 2005 Feb;20(2):173-81.
- Nucci MR, Robinson CR, Longo P, Campbell P, Hamilton SR. Phenotypic and genotypic characteristics of aberrant crypt foci in human colorectal mucosa. Hum Pathol 1997 Dec;28(12):1396-407.
- Takayama T, Katsuki S, Takahashi Y, Ohi M, Nojiri S, Sakamaki S, et al. Aberrant crypt foci of the colon as precursors of adenoma and cancer. N Engl J Med 1998 Oct 29;339(18):1277-84.
- Stevens RG, Swede H, Heinen CD, Jablonski M, Grupka M, Ross B, et al. Aberrant crypt foci in patients with a positive family history of sporadic colorectal cancer. Cancer Lett 2007 Apr 18;248(2):262-8.
- Kim J, Ng J, Arozulllah A, Ewing R, Llor X, Carroll RE, et al. Aberrant crypt focus size predicts distal polyp histopathology. Cancer Epidemiol Biomarkers Prev 2008 May;17(5):1155-62.
- Uchiyama T, Takahashi H, Endo H, Kato S, Sakai E, Hosono K, et al. Number of aberrant crypt foci in the rectum is a useful surrogate marker of colorectal adenoma recurrence. Dig Endosc 2012 Sep;24(5):353-7.
- Takahashi H, Yamada E, Ohkubo H, Sakai E, Higurashi T, Uchiyama T, et al. Relationship of human rectal aberrant crypt foci and formation of colorectal polyp: One-year following up after polypectomy. World J Gastrointest Endosc 2012 Dec 16;4(12):561-4.
- Gupta AK, Schoen RE. Aberrant crypt foci: are they intermediate endpoints of colon carcinogenesis in humans? Curr Opin Gastroenterol 2009 Jan;25(1):59-65.
