Pseudoaneurisma de arteria esplénica como causa de hemorragia digestiva alta en pacientes con pancreatitis crónica. Reporte de dos casos.
Cristina Torres, Hipólito Fernández, Víctor Escrich, Ángela Martínez, Ramiro Carreño, Begoña Sacristán
Servicio de Aparato Digestivo del Complejo Hospitalario San Millán-San Pedro, Logroño, La Rioja.
RESUMEN
Los pseudoaneurismas arteriales son una complicación rara de la pancreatitis crónica y al romperse presentan una mortalidad elevada. El presente trabajo presenta dos casos de hemorragia digestiva alta secundarios a pseudoaneurismas de arteria esplénica en pacientes con pancreatitis crónica. Ambos con forma de presentación de hemorragia digestiva alta. En el primero desencadenó la muerte del paciente a pesar de dos intervenciones quirúrgicas. En el segundo caso se realizó una embolización con éxito terapéutico y posterior derivación del paciente a la consulta de cirugía vascular para corrección programada del pseudoaneurisma.
PALABRAS CLAVE Pseudoaneurisma, pancreatitis crónica.
INTRODUCCIÓN
Los pseudoaneurismas arteriales son una complicación rara de la pancreatitis crónica (10%) 1,2,7. Las estructuras vasculares involucradas son la arteria esplénica (la más frecuente), gastroduodenal, gástrica, gastroepiploica o arteria hepática 2,3. La dificultad diagnóstica es alta y algunas ocasiones puede ser un hallazgo incidental en la ecografía doppler abdominal 1,3. Suelen ser asintomá- ticos y al romperse (50% de los casos) pueden manifestarse con hemorragia digestiva alta. La forma más frecuente de presentación es la hemorragia digestiva alta seguida por la hemorragia hacia el ducto pancreático (hemosuccus pancreaticus). Esta patología representa un reto diagnóstico y para poder diagnosticarla se requiere de un alto índice de sospecha clínica. El diagnóstico temprano y la elección del tratamiento adecuado son cruciales dado que al romperse, su mortalidad alcanza el 29% a pesar del tratamiento y alrededor del 90% sin él1.
CASO 1
Varón de 53 años con antecedente de pancreatitis crónica de origen enólico con múltiples episodios de reagudización. Tras episodio en el 2012 desarrolló pseudoquistes pancreáticos. Ingresó a cargo del servicio de digestivo por melenas, con inestabilidad hemodinámica y cetoacidosis diabética como debut. Se realizó gastroscopia evidenciando ulceración en la papila duodenal. El TAC abdominal evidenció colección heterogénea e hiperdensa en cabeza pancréatica, papila y tercera porción duodenal compatible con hematoma. La angioTAC objetivó un foco de extravasación de contraste en el interior del hematoma descrito, sugiriendo sangrado activo de una rama de la arteria que irrigaba la cabeza pancreática, con salida al duodeno a través de la papila. Luego de este hallazgo se llevaron a cabo dos arteriografías sin lograr localizar el punto de sangrado. El paciente precisó de transfusión de ocho concentrados de hematíes, cuatro unidades de plasma fresco y tres de plaquetas para su estabilización hemodinámica.

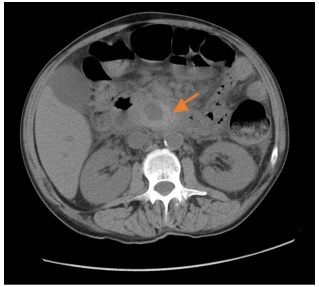
Figura 1.- TAC con contraste: colección heterogénea en cabeza pancréatica, papila y tercera porción duodenal, correspondiente con sangrado de pseudoaneurisma.

Figura 2.- Clasificación TAC con contraste: colección hemática adyacente a la curvatura mayor gástrica de 8,3 x 6,4 cm, hallazgos sugestivos de pseudoaneurisma dependiente de la arteria esplénica.
Además al cuarto día de ingreso presentó pico febril de 38ºC, los hemocultivos fueron positivos para Eschericia coli multisensible, por lo que se inició terapia intravenosa con piperacilina tazobactam. Se realizó nuevo TAC abdominal que mostró el hematoma descrito con disminución de tamaño a 26×27 mm y en el angioTAC persistencia de extravasación de contraste compatible con sangrado activo proveniente de una rama de la arteria pancreática ya observado en las pruebas anteriores. Además colecciones peripancreáticas con burbujas de gas sugiriendo sobreinfección de las mismas.

Figura 3.- AngioTAC: Pseudoaneurisma de arteria esplénica.
El diagnóstico de pseudoaneurisma de arteria esplé- nica fue establecido mediante TAC y angioTAC, confirmándose mediante laparotomía exploratoria que se decidió realizar dada la inestabilidad hemodinámica y la ausencia de localización del pseudoaneurisma en las dos arteriografías realizadas. En el acto quirúrgico se procedió a la disección de la arteria hepática hasta la salida de la arteria gastroduodenal con ligadura de la misma y se evidenció además un absceso entre fundus gástrico y páncreas que se desbridó. Se trasladó al paciente a la unidad de cuidados intensivos en la cual presentó nuevamente inestabilidad hemodinámica requiriendo una segunda intervención quirúrgica en la que se evidenció flemón pancreático afectando cabeza y cuerpo pancreáticos, realizándose liberación pancreática con ligadura de vasos peripancreáticos. Lamentablemente, el paciente falleció a las 48 horas de la segunda intervención en la unidad de cuidados intensivos.
CASO 2
Paciente varón de 61 años con antecedentes de diabetes mellitus tipo 2, historia de abuso de alcohol y dos episodios de pancreatitis aguda de origen enólico. Ingresó en la planta de digestivo por hemorragia digestiva alta (hematemesis masiva) con importante repercusión hemodinámica. Requirió transfusiones de seis concentrados de hematíes y dos unidades de plasma fresco.

Figura 4.- Coils de embolización en la arteria esplénica.
La primera gastroscopia evidenció en bulbo, cara posterosuperior, una lesión de apariencia tumoral de 2cm de diámetro que ocupaba la mitad de la circunferencia del marco duodenal, provocando una estenosis leve y que presentaba ulceración central con coágulos. Se realizó esclerosis con 4cc de solución de adrenalina 1/10000. Se realizaron biopsias de los bordes de la úlcera siendo los resultados de anatomía patológica negativos para malignidad. Se repitió la gastroscopia por persistencia de sangrado, evidenciando un coágulo grande en fundus, restos hemáticos frescos en cuerpo y antro que provenían de duodeno. En bulbo duodenal hacia cara postero-superior, lesión ulcerada. Se realizó hemostasia endoscópica combinada (adrenalina y clips metálicos). Se solicitó TAC abdominal ante sospecha endoscópica de lesión tumoral duodenal y dado que la anatomía patológica no fue concluyente, se pidió una ecoendoscopia. A la espera de dicho procedimiento, el paciente presentó un nuevo episodio de sangrado digestivo y al ser la terapia endoscópica combinada (hemoclips y adrenalina) ineficaz, se solicitó estudio angiográfico. Éste evidenció pseudoaneurisma de la arteria esplénica, decidiéndose llevar a cabo embolización con colocación de hidrocoils. Tras dos sesiones de embolización se obtuvo hemostasia definitiva. La angioTAC de control, confirmó la efectividad de la embolización y tras siete días, el paciente fue dado de alta con controles posteriores a cargo del servicio de cirugía vascular y actualidad se encuentra pendiente de cirugía específica para corrección de la lesión vascular.
DISCUSIÓN
Los pseudoaneurismas constituyen una complicación seria de la pancreatitis crónica. Al efectuar la revisión de la literatura existente para esta patología encontramos que el 46% se debe a la existencia previa de pancreatitis crónica, constituyendo la principal causa seguida por la post-traumática5 . En el caso de pancreatitis crónica, el antecedente de abuso en el consumo de alcohol está presente en la mayoría de pacientes, en este trabajo ambos pacientes lo presentaban. En relación con la etiopatogenia se han propuesto tres mecanismos. En primer lugar, un proceso inflamatorio severo y la autodigestión enzimática producida sobre una arteria pancreática o peripancreática, que producirían la disrupción de la pared vascular y la formación del pseudoaneurisma. El segundo mecanismo planteado es el de un pseudoquiste ya formado, que puede producir la erosión de la arteria y convertir el pseudoquiste en un pseudoaneurisma. Por último, el tercer mecanismo en el que un pseudoquiste erosiona la pared intestinal y provoca sangrado en el interior de la superficie mucosa.6, 11 En los casos aquí reportados el mecanismo que pudo originar el pseudoaneurisma pudo haber sido una combinación de los tres. La clínica varía desde un hallazgo incidental hasta un shock hemodinámico secundario a la ruptura del pseudoaneurisma. Los síntomas más frecuentes descritos en la literatura son el dolor abdominal (29.5%), hematoquecia o melenas (26.2%), hemosuccus pancreaticus (20.3%) y hematemesis (14.8%)5 . El diagnóstico se realiza por TAC o arteriografía, siendo esta última la adecuada por su valor terapéutico mediante la embolización. En los dos casos presentados se realizó arteriografía para confirmar el diagnóstico, siendo imposible la embolización al no poder cateterizarse la arteria esplénica en uno de ellos. El tratamiento consiste en la corrección quirúrgica e implica una esplenectomía y la resección de la porción de arteria esplénica que engloba el pseudoaneurisma (aneurismectomia). La pancreatectomía distal se recomienda cuando los aneurismas están íntimamente embebidos en el tejido pancreático. Si el bazo es preservado durante una aneurismectomia, se recomienda la reconstrucción vascular ya que de no realizarla existe riesgo infarto esplénico o formación de absceso 9. La ligadura laparoscópica ha sido descrita para la corrección de aneurismas de arteria esplénica pero la experiencia con este procedimiento es limitada. Eso ha dado cabida a que la terapia endosvascular sea un tratamiento emergente y cada vez más utilizado para esta patología sobretodo en pacientes sintomáticos, como en los casos descritos en este trabajo. Existe un consenso acerca de los casos en los que se debe realizar el tratamiento en pacientes asintomáticos. La recomendación se enfoca en pacientes embarazadas y en mujeres en edad fértil, ya que existe un aumento de riesgo de ruptura de los aneurismas durante el embarazo, aumentando de manera significativa la tasa de mortalidad materno-fetal 9.
CONCLUSIÓN
La ruptura de los pseudoaneurismas pancreáticos puede presentarse como hemorragia digestiva alta y tiene una mortalidad muy elevada. La angiografía es el método diagnóstico de elección y el tratamiento la embolización en pacientes sintomáticos. Si existe recurrencia del sangrado o la embolización no es efectiva se deberá proceder al tratamiento quirúrgico. Se recomienda la corrección quirúrgica en casos asintomáticos, en pacientes embarazadas o en edad fértil.
REFERENCIAS
1. B. P. Kandel, B. Ghimire, P. J. Lakhey, U. K. Shrestha, M. Khakurel, Upper gastrointestinal bleeding in chronic pancreatitis. Journal of Institute of Medicine, August, 2010; 32:2
2. Hourani SA, Al-Bdour MN, Rashaideh MA, Al-Nawayseh KR, Alasmar AA, Alkasasbeh MA, et al. Chronic pancreatitis complicates pancreatic pseudocyst: importance of early detection and management. J Surg Pak 2008;13:42-5.
3. Benoit L, Fraisse J, Cercueil JP, Cornet A, Cuisenier J. Gastroduodenal arterial aneurysm and chronic pancreatitis. A case and review of the literature. Ann Chir 1996; 50(10):918-20.
4. Peeyush Varshney, Bhupen Songra, Shivank Mathur, et al. “Splenic Artery Pseudoaneurysm Presenting as Massive Hematemesis: A Diagnostic Dilemma” Case Reports in Surgery, vol 2014, Article ID 501937, 3 páginas, 2014.
5. Deron J. Tessier, MD,a William M. Stone, MD,a Richard J. Fowl, MD,a Maher A. Abbas, MD,a James C. Andrews, MD,b Thomas C. Bower, MD,c and Peter Gloviczki, MD,c Scottsdale, Ariz; and Rochester, Minn. Clinical features and management of splenic artery pseudoaneurysm: Case series and cumulative review of literatura. J Vasc Surg 2003;38:969-74.
6. M. A. Alcázar Iribarren-Marín y col. Seudoaneurisma de la arteria mesentérica superior tras pancreatitis aguda. Embolización mediante microcoils. Radiología 2001; 43(6):303-6.
7. A. B. Argibay Filgueira, B. Maure Noia, P. Lamas Domínguez, C. Martínez-Vázquez. Pseudoaneurisma de arteria esplénica como complicación de pancreatitis. Cartas al editor. An Med Interna (Madrid) ;23(4).
8. Deron J Fessier, William M Stone, Richard J Fowl, Maher A Abbas, James C Andrews, Thomas C Bower et al. Clinical features and management of splenic artery psedoaneurysm: case series and cumulative review of literature. J Vasc Surg 2003.
9. Visceral Artery Aneurysm: Risk Factor Analysis and Therapeutic Opinion Y. K. Huang, H.C. Hsieh, F.C. Tsai, S. H. Chang, M.S. Lu and P.J. Ko. Eur J Vasc Endovasc Surg 33, 293e301 2007.
10. Ferreira J, Tavares AB, Costa E1, Maciel J. Hemosuccus pancreaticus: a rare complication of chronic pancreatitis. BMJ Case Rep 2015 Jun 25.
11. Herrera-Fernández FA y col. Rupture of splenic artery pseudoaneurysm: an unusual cause of upper gastrointetinal bleeding. Cir Cir 2014 Sep-Oct; 82(5):551-5