¿Tiene fundamento la introducción precoz del anti-TNF en la colitis ulcerosa?
Manuel Barreiro-de Acosta y Daniel de la Iglesia
Unidad de Enfermedad Inflamatoria Intestinal. Servicio de Aparato Digestivo. Hospital Clínico Universitario de Santiago.
Correspondencia:
Manuel Barreiro-de Acosta
Unidad de Enfermedad Inflamatoria Intestinal
Servicio de Aparato Digestivo
Hospital Clínico Universitario de Santiago
INTRODUCCIÓN
El término precoz está siendo empleado con frecuencia cuando se discuten las distintas estrategias de tratamiento en la enfermedad inflamatoria intestinal. Sin duda ha sido en la enfermedad de Crohn (EC) donde se ha demostrado una mayor evidencia. Los sub-análisis de los estudios pivotales tanto con infliximab (IFX) como con adalimumab (ADA) en EC mostraron no solo que eran fármacos eficaces, sino que también fueron capaces de modificar aspectos importantes para los pacientes como son el hecho de disminuir hospitalizaciones y cirugías (1,2). Además los datos que provenían de estudios posteriores demostraron que la introducción precoz de las terapias biológicas era mucho más efectiva que el uso de estos fármacos en formas más evolucionadas de la enfermedad (3-5). Sin embargo este concepto que parece claro, en colitis ulcerosa (CU) resulta mucho más controvertido.
¿POR QUÉ SE HAN EMPLEADO LOS BIOLÓGICOS MÁS TARDE EN LA COLITIS QUE EN EL CROHN?
Son muchas las razones que han influido en que unos fármacos que ha demostrado una eficacia tan alta para la EC hayan tardado tanto en emplearse en la CU, con la consecuencia de que en un principio se reservaron para los casos más graves y hasta hace poco tiempo no se ha valorado la introducción precoz.
La primera razón por la que se ha retrasado su introducción es que a pesar de que en líneas generales en ambas enfermedades se produce un desequilibrio entre las citoquinas proinflamatorias y las anti-inflamatorias, clásicamente a la CU se la consideraba desde el punto de vista inmunológico una enfermedad tipo Th2 (mayor rol de IL-10 e IL-5 y menor de TNF-a e IL-12) (6), en contraste con la EC, enfermedad claramente definida como tipo Th1 en la que TNF-a desempeña un papel predominante. Estos datos hicieron replantearse la potencial eficacia de los agentes anti-TNF-a en la CU; sin embargo otros estudios posteriores han demostrado que TNF-a puede tener un papel en la etiopatogenia de la CU, justificando el empleo de las terapias anti-TNF-a en esta patología (7).
La segunda razón es que cuando las terapias biológicas se introdujeron en la EC supuso una verdadera revolución, pues no existía una alternativa terapéutica, salvo la cirugía, para este tipo de pacientes, mientras que en la CU grave refractaria a corticoesteroides existía un tratamiento: la ciclosporina (CsA) que se utilizaba con regularidad en la práctica clínica. Sin embargo, a pesar de que la CsA estaba y continúa estando en el arsenal terapéutico habitual del manejo de estos pacientes, la evidencia científica que la apoya es escasa pero contundente. Existe solamente un estudio prospectivo, aleatorio y controlado con placebo en CU grave refractaria a corticoides (8), en el que únicamente se incluyeron 20 pacientes (no se consideró ético seguir tras los resultados preliminares) en el que se observó una respuesta inicial (remisión clínica) con CsA del 80% frente al 0% con placebo.
La tercera razón por la que se ha retrasado fue que, a pesar que en las primeras series abiertas de pacientes con CU corticorresistente tratados con IFX los resultados eran esperanzadores, el primer ensayo clínico multicéntrico doble ciego controlado con placebo realizado (9) que tenía planeada la inclusión de 60 pacientes, se cerró prematuramente por el lento reclutamiento, a pesar de la tendencia a mejor respuesta en los tratados con IFX (respuesta en el 50% de los pacientes tratados con fármaco y 0% en los tratados con placebo). Las dudas sobre la eficacia de IFX en la CU no se difuminaron tras la publicación del primer ensayo clínico randomizado que comparaba IFX (5 mg/kg en las semanas 0 y 2) con placebo en pacientes con CU moderada-grave corticoresistente (10). En este estudio multicéntrico realizado en 43 pacientes no se encontraron diferencias entre pacientes tratados con fármaco y los tratados con placebo en cuanto a la eficacia clínica y endoscópica en la semana 6, ni en cuanto a la mejoría de la calidad de vida medida a través de dos escalas. Probablemente algunas limitaciones del estudio como el hecho de ser solamente dos dosis, una evaluación muy temprana de los pacientes, la gran heterogeneidad de la definición de corticorresistencia y la exclusión de los pacientes muy graves, pudo influir en la relativamente alta respuesta a placebo (30% de remisión endoscópica) y ayudar a justificar estos resultados.
¿POR QUÉ NO SE PLANTEÓ EN UN PRINCIPIO TRATAMIENTO PRECOZ EN LA CU?
Una de las causas por las que no se planteó la utilización precoz de estos fármacos fue que los primeros estudios publicados se realizaron en pacientes graves corticorresistentes, aunque con el tiempo, como veremos, los biológicos cada vez se han empleado con más frecuencia en situaciones de no tan extrema gravedad. Los datos en las colitis graves proceden del estudio multicéntrico controlado, randomizado y doble ciego realizado en países escandinavos, que comparaba IFX con placebo, ha sido el que ha aportado una mayor evidencia hacia el empleo de IFX en CU refractaria a esteroides (11). En este estudio se incluyeron 45 pacientes con CU moderada-grave con fracaso a tratamiento esteroideo. Los pacientes recibieron aleatoriamente una única dosis de IFX (4 ó 5 mg/kg) o placebo, fueron posteriormente seguidos durante tres meses siendo el objetivo principal del estudio la proporción de pacientes colectomizados o fallecidos en ese período de tiempo. Un 67% de los pacientes tratados con placebo fueron colectomizados en comparación con el 29% de los tratados con IFX (p=0,017). Con estos resultados, los autores concluyen que IFX es efectivo y bien tolerado en los pacientes con CU grave, aunque resaltan un dato que apoyará indirectamente el empleo más temprano de estos fármacos, como fue el hecho de que IFX tenía menor eficacia en las CU más fulminantes.
ESTUDIOS PIVOTALES
Indirectamente los resultados de los estudios pivotales tanto con IFX, ADA y Golimumab (GLM) nos han demostrado que los fármacos anti-TNF pueden ser eficaces en las colitis moderadas (12-14) , si bien es cierto que resulta difícil estratificar los pacientes, pues mientras que en algún ensayo se incluían desde colitis moderadas-graves hasta pacientes refractarios a mesalazinas, lo que resultó común era el hecho de que todos los pacientes de los ensayos eran pacientes ambulatorios no hospitalizados y se excluían los pacientes más graves. En estos ensayos, con independencia de la polémica por las bajas tasas de remisión, se alcanzaron diferencias significativas entre los fármacos y placebo, por lo que se concluye que los 3 fármacos son eficaces en la colitis moderada grave no hospitalizada.
Por otra parte en los estudios post-hoc de los ensayos pivotales con IFX y ADA se demostró la eficacia de estos fármacos en aspectos sumamente importantes para los pacientes, como son el hecho de disminuir la hospitalizaciones, disminuir las tasas de colectomía y sobre todo mejorar la calidad de vida de los pacientes (15-17). Estos aspectos merecen una reflexión, dado que si en EC estos mismos datos impulsaron a que autores de prestigio interpretasen que todos estos hallazgos podría cambiar la historia natural de la enfermedad y que podría ser beneficioso el tratamiento precoz en la EC. ¿Por qué no aplicar estos mismos parámetros en la CU para un cambio en la historia natural y justificar la terapia precoz?
SERIES DE PACIENTES NO HOSPITALIZADOS
No solo los datos de los estudios pivotales aportan argumentos sobre los pacientes no hospitalizados, la publicación de series abiertas de tratamiento de CU tanto con IFX como con ADA, supuso una mayor información sobre la eficacia de estas terapias en la vida real. Una constante común de estas series ha sido que las tasas de remisión y respuesta han sido muy superiores a las de los ensayos clínicos controlados. Sin duda la principal causa de estos resultados es que la gran mayoría de los pacientes tratados eran ambulatorios, no hospitalizados y por lo tanto esto significaba que eran tratados de una manera más precoz. Probablemente el estudio que nos aporta una mayor información es el estudio prospectivo canadiense que trató a 53 pacientes naive con CU no hospitalizada tanto con IFX (n=28) como con ADA (n=25) indistintamente. En este estudio se obtuvieron unas tasas de respuesta inicial superiores al 75% con ambos fármacos y unas tasas de respuesta mantenida superiores al 70% también con ambos. Tras un análisis detallado del estudio la causa de tales tasas de respuesta puede deberse a que la gran mayoría de los pacientes tenían una CU moderada y ninguno estaba ingresado en el momento de iniciar el tratamiento, por lo tanto se puede considerar como un tratamiento relativamente precoz (18).
El grupo de Leuven nos aporta interesantes datos en 121 pacientes con CU tratados con IFX, se trata de en su gran mayoría de no corticorrefractarios, por lo que podemos interpretar que son de tratamiento más precoz; en los que se obtuvieron unas tasas de respuesta mantenida en el 67% de los mismos, de nuevo cifras superiores a las de los ensayos clínicos. Aunque es difícil de valorar aisladamente este dato, la media de tiempo desde el diagnóstico al tratamiento era inferior a 6 años, por lo que podemos considerar que, si bien no se trataron precozmente, tampoco era una cohorte con una evolución tan larga como en otros estudios (19). Con ADA existen menos series abiertas y, salvo la canadiense, la gran mayoría de los estudios incluyen pacientes previamente tratados con IFX, por lo que no se les puede considerar precoces. A pesar de ello, en una serie italiana con 80 pacientes, la gran mayoría no naive, se alcanzaron tasas de remisión clínica al año superiores al 40% (20).
Con todos estos datos parece claro que el tratamiento en pacientes no hospitalizados y por lo tanto más precozmente es una estrategia más eficaz que esperar a que los pacientes con CU estén más graves. Sin embargo, el único estudio que dentro de un mismo centro ha comparado la eficacia de IFX entre el paciente moderado y el paciente grave es un estudio canadiense que incluyó 115 pacientes, de los cuales 73 pertenecían al grupo con enfermedad moderada no hospitalizados, mientras que los otros 42 eran pacientes con CU grave y hospitalizados (21). En la semana 54 las tasas de respuesta fueron del 60% en los no hospitalizados y del 29% en los hospitalizados (p=0,003), mientras que las tasas de remisión fueron del 45% en los no hospitalizados comparado con el 19% de los hospitalizados (p=0,009).
CORTICODEPENDENCIA
La corticodependencia no es una situación extraña en la colitis ulcerosa, esta situación puede afectar a casi el 30% de los pacientes que inician tratamiento con esteroides. Según las guías clínicas los fármacos de elección en estas situaciones son los inmunosupresores tiopurínicos (22), sin embargo más del 40% de los pacientes no son capaces de retirar los corticoides con estos fármacos, y hasta en otro 15% tienen que abandonar el tratamiento como consecuencia de los efectos adversos. Por todo ello, las terapias biológicas parecen ser una alternativa razonable en este tipo de pacientes, que podríamos indirectamente considerarlos como un subgrupo de pacientes relativamente precoces, puesto que normalmente no ingresan y el riesgo de colectomía es más limitado.
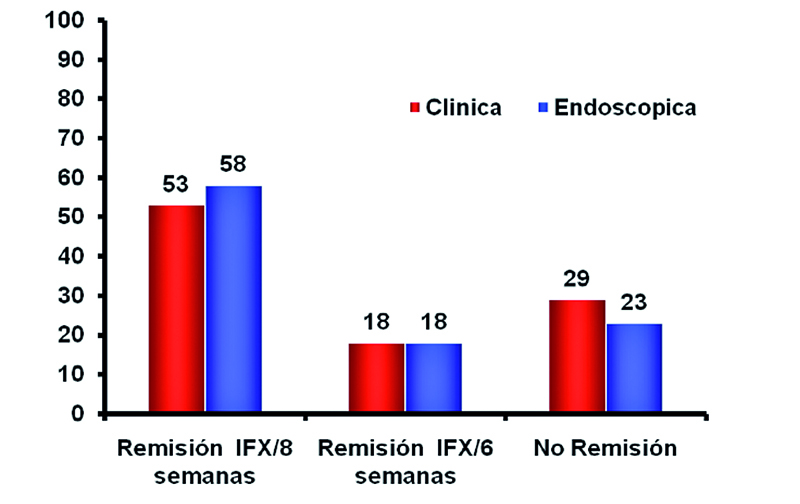
A pesar de que su utilización en la práctica clínica no es infrecuente, existen muy pocos estudios que evalúen la eficacia de estos fármacos en la CU corticodependiente. En muestro grupo hemos publicado un estudio abierto prospectivo en el que se evaluó la eficacia clínica y endoscópica de IFX en 17 pacientes con CU corticodependientes, todos ellos refractarios o intolerantes a azatioprina (23). Los resultados a dos años mostraron una remisión clínica y endoscópica superior al 50%, con una alta concordancia entre ambos hallazgos. Por otra parte también se observó que casi el 20% de los pacientes que habían perdido respuesta volvían a alcanzar la remisión tras intensificar el tratamiento (Figura 1). En otro estudio italiano posterior, pero con un mayor número de pacientes tratados con IFX (n=126) tras una alta tasa de respuesta inicial (76%), de los respondedores el 64% continuaban a largo plazo en remisión sin esteroides, siendo los resultados bastante similares a los previamente descritos (24). En la corticodependencia, con ADA existe el mismo problema previamente descrito en las series de pacientes no hospitalizados con CU moderada, que es que en la mayoría de los estudios un número elevado de pacientes no son naive y por lo tanto no son tan precoces. Sin embargo en este subgrupo de pacientes se aportan datos interesantes de eficacia. En el estudio multicéntrico italiano con 40 CU corticodependientes tratadas con ADA, el 60% fue capaz de retirar los esteroides (20) y, en un reciente estudio realizado en nuestro medio en dos hospitales de referencia, en 37 pacientes con CU corticodependiente, el 40% alcanzó la remisión sin esteroides (Figura 2). Además también se comprobó un descenso significativo de los reactantes en fase aguda como son la calprotectina y la proteína C reactiva (25).
POBLACIÓN PEDIÁTRICA
Sin duda la población pediátrica puede considerarse una población de la que se pueden extraer conclusiones con respecto al tratamiento precoz. De nuevo, la mayoría de los datos provienen de la EC, donde sin duda las terapias biológicas han demostrado una eficacia superior a los adultos y se sitúan cada vez más precozmente en los algoritmos de tratamiento. Sin embargo, en la CU pediátrica parece que se está siguiendo el mismo patrón que ocurrió con los adultos y la introducción no parece ser tan precoz y reservarse para casos más graves. Con IFX en un estudio en 52 pacientes pediátricos con CU las tasas de respuesta fueron elevadas en la inducción, pero al año y a los 2 años, a pesar de que se evitaron múltiples colectomías, las tasas de remisión fueron inferiores a las publicadas con EC (26). La experiencia con ADA en edad pediátrica es menor, sin embargo se han referido algunos abstracts a congresos con unas tasas de remisión superiores al 50%, siendo estos datos muy positivos al ser sobre poblaciones refractarias a múltiples tratamientos (27).
Figura 1.- Porcentaje de pacientes corticodependientes con remisión clínica y endoscópica en la semana 104.

Figura 2.- Porcentajes de remisión sin esteroides en pacientes con CU corticodependientes tratados con adalimumab.

PREDICTORES DE RESPUESTA
De nuevo los datos que tenemos en CU sobre un aspecto tan importante para los clínicos, y que tanto se ha discutido en la EC, como es conocer potenciales predictores de mejor respuesta a las terapias biológicas, son muy limitados (28). Sin embargo, con respecto al tratamiento precoz, existen algunas publicaciones que parecen apoyar el mismo. De nuevo, datos del grupo de Leuven sobre los 100 primeros pacientes tratados con IFX, muestran que tras analizar potenciales predictores de respuesta, se observó que los pacientes más jóvenes tenían una respuesta más rápida y parecía ser más efectiva la terapia (29). Pero por otra parte, en un sub-análisis de los estudios ACT, se observaron unas mayores tasas de colectomía entre los pacientes con menos de 3 años de duración de la enfermedad (17), por lo que pensamos que se necesitan más estudios sobre este tema para evaluar el papel de los años de duración de la enfermedad en la predicción de la respuesta a las terapias biológicas en los pacientes con CU.
HISTORIA NATURAL DE LA ENFERMEDAD
Recientemente han aparecido publicaciones que nos han hecho reflexionar sobre los aspectos crónicos y la mayor gravedad de la CU. Hasta ahora, como ha quedado perfectamente reflejado en la revisión de los estudios que hemos realizado, existía el pensamiento de que la CU era una entidad menos grave y con una menor carga de cronicidad. Sin embargo en la CU la progresión de la enfermedad puede adoptar y manifestarse de varias formas. Las CU pueden extenderse proximalmente, y la mayor afectación va a traer acarreada una mayor gravedad y una mayor necesidad de tratamiento (30). Existen otros aspectos característicos de progresión de la CU como son la formación de estenosis, pseudopólipos y fibrosis en puentes, dismotilidad y la disfunción anorectal que son muy difícilmente medibles pero que van a condicionar, sobre todo estos últimos, la calidad de vida de los pacientes con CU (31).
Con respecto a la calidad de vida, existe el pensamiento de que en general la mayoría de los pacientes con CU están en remisión y que tienen una buena calidad de vida, pero disponemos de datos recientes que nos muestran que la calidad de vida y toda su morbilidad psicológica es tan importante en la CU como en la EC, independientemente de que los pacientes se encuentren en actividad o en remisión (32). Además a través de encuestas poblacionales se ha demostrado que los pacientes se sienten peor de lo que los médicos que los tratamos en la consulta pensamos (33).
Un último aspecto que parece condicionar el carácter más benigno de la CU era el hecho de que mientras que para la EC se busca una remisión más completa no solo clínica, sino también endoscópica, parece que para la CU hay un mayor conformismo con la curación mucosa. De hecho, todos los estudios pivotales se “conforman” con una definición de curación mucosa como Mayo-0 ó Mayo-1 endoscópico (12-14), pero en nuestro grupo hemos observado que los pacientes con un Mayo-1 endoscópico tienen unas tasas de recidiva a los 6 meses muy superiores a aquellos con Mayo-0 (34).
Todos estos datos nos pueden hacer reflexionar sobre la necesidad de no esperar tanto en el tratamiento de la CU, y ver que es necesario en ocasiones ser más precoz para evitar consecuencias irreversibles o para lograr la restauración total de la calidad de vida y de la mucosa de nuestros pacientes
CONCLUSIONES
Las terapias biológicas son unos fármacos eficaces en el tratamiento de la CU. La principal incógnita es evaluar qué lugar ocupan en la terapéutica de esta enfermedad. Además de para las situaciones de brote grave corticorrefractario, se deben emplear en brotes moderados no hospitalizados y en la CU corticodependiente, pues los datos de los estudios no sólo avalan dicha posibilidad, sino que muestran las mejores tasas de respuesta y remisión en estos dos subgrupos de pacientes. Por último, al igual que ha ocurrido con la EC, probablemente en el futuro próximo deba valorarse el empleo precoz de las terapias biológicas en determinados casos de CU (serán necesarios estudios de factores predictivos) para intentar prevenir complicaciones posteriores. Lo que parece claro a día de hoy es que debemos saber que en la CU tan importante como el término precoz, es el término “no demasiado tarde”.
REFERENCIAS
1. Lichtenstein GR, Yan S, Bala M, Blank M, Sands BE. Infliximab maintenance treatment reduces hospitalizations, surgeries, and procedures in fistulizing Crohn’s disease. Gastroenterology 2005;128:862-9
2. Feagan BG, Panaccione R, Sandborn WJ, D’Haens GR, Schreiber S, Rutgeerts PJ, et al. Effects of adalimumab therapy on incidence of hospitalization and surgery in Crohn’s disease: results from the CHARM study. Gastroenterology 2008;135:1493-9.
3. Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease N Engl J Med 2010;362:1383-95.
4. D’Haens G, Baert F, van Assche G, Caenepeel P, Vergauwe P, Tuynman H, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet 2008;371:660-667.
5. Schreiber S, Reinisch W, Colombel JF, Sandborn WJ, Hommes DW, Robinson AM, et al. Subgroup analysis of the placebo-controlled CHARM trial: increased remission rates through 3 years for adalimumab-treated patients with early Crohn’s disease. J Crohns Colitis 2013;7:213-21.
6. Blam ME, Stein RB, Lichtenstein GR. Integrating anti-tumor necrosis factor therapy in inflammatory bowel disease: current and future perspectives. Am J Gastroenterol 2001;96:1977-97.
7. Strober W, Fuss IJ. Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases. Gastroenterology 2011;140:1756-67
8. Lichtiger S, Present DH, Kornbluth A, Gelernt I, Bauer J, Galler G, et al. Cyclosporine in severe ulcerative colitis refractory to steroid therapy. N Engl J Med 1994;330:1841-5.
9. Sands BE, Tremaine WJ, Sandborn WJ, Rutgeerts PJ, Hanauer SB, Mayer L, et al. Infliximab in the treatment of severe, steroid-refractory ulcerative colitis: a pilot study. Inflamm Bowel Dis 2001;7:83-8.
10. Probert CS, Hearing SD, Schreiber S, Kühbacher T, Ghosh S, Arnott ID, et al. Infliximab in moderately severe glucocorticoid resistant ulcerative colitis: a randomised controlled trial. Gut 2003;52:998-1002.
11. Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005;128:1805-11
12. Rutgeerts P, Sandborn WJ, Feagan BG, Reinisch W, Olson A, Johanns J, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005;353:2462-76.
13. Sandborn WJ, van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012;142:257-65.
14. Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, et al.Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014;146:85-9.
15. Feagan BG, Reinisch W, Rutgeerts P, Sandborn WJ, Yan S, Eisenberg D, et al. The effects of infliximab therapy on health-related quality of life in ulcerative colitis patients. Am J Gastroenterol 2007;102:794-802.
16. Feagan BG, Sandborn WJ, Lazar A, Thakkar RB, Huang B, Reilly N, et al. Adalimumab therapy is associated with reduced risk of hospitalization in patients with ulcerative colitis. Gastroenterology 2014;146:110-18.
17. Sandborn WJ, Rutgeerts P, Feagan BG, Reinisch W, Olson A, Johanns J, et al. Colectomy rate comparison after treatment of ulcerative colitis with placebo or infliximab. Gastroenterology 2009;137:1250-60.
18. Gies N, Kroeker KI, Wong K, Fedorak RN. Treatment of ulcerative colitis with adalimumab or infliximab: long-term follow-up of a single-centre cohort. Aliment Pharmacol Ther 2010;32:522-8.
19. Ferrante M, Vermeire S, Fidder H, Schnitzler F, Noman M, Van Assche G, et al. Long-term outcome after infliximab for refractory ulcerative colitis. J Crohns Colitis 2008;2:219-25.
20. Italian Group for the Study of Inflammatory Bowel Disease, Armuzzi A, Biancone L, Daperno M, Coli A, Pugliese D, et al. Adalimumab in active ulcerative colitis: a “real-life” observational study. Dig Liver Dis 2013;45:738-43.
21. Seow CH, Newman A, Irwin SP, Steinhart AH, Silverberg MS, Greenberg GR. Trough serum infliximab: a predictive factor of clinical outcome for infliximab treatment in acute ulcerative colitis. Gut 2010;59:49-54.
22. Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, Allez M, et al.Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012;6:991-1030.
23. Barreiro-de Acosta M, Lorenzo A, Mera J, Domínguez-Muñoz JE. Mucosal Healing and Steroid-Sparing Associated with Infliximab for Steroid-Dependent Ulcerative Colitis. J Crohns Colitis 2009;3:271-6.
24. Armuzzi A, Pugliese D, Danese S, Rizzo G, Felice C, Marzo M, et al. Long-term combination therapy with infliximab plus azathioprine predicts sustained steroid-free clinical benefit in steroid-dependent ulcerative colitis. Inflamm Bowel Dis 2014;20:1368-74.
25. Barreiro-De Acosta M, Munoz F, Sierra M, Garcia Alvarado M, Lorenzo A, Dominguez-Munoz JE. Efficacy of adalimumab treatment in steroid dependent ulcerative colitis patients. UEG Journal 2014;2:A380.
26. Hyams JS, Lerer T, Griffiths A, Pfefferkorn M, Stephens M, Evans J, et al. Outcome following infliximab therapy in children with ulcerative colitis. Am J Gastroenterol 2010;105:1430-6.
27. Volonaki E, Kiparissi F, Shah N, Lindley KJ, Elawad M. Adalimumab in refractory paediatric ulcerative colitis. J Crohns Colitis 2014;8:S-435-6.
28. Zampeli E, Gizis M, Siakavellas SI, Bamias G. Predictors of response to anti-tumor necrosis factor therapy in ulcerative colitis. World J Gastrointest Pathophysiol 2014;5:293-303.
29. Ferrante M, Vermeire S, Katsanos KH, Noman M, Van Assche G, Schnitzler F, et al. Predictors of early response to infliximab in patients with ulcerative colitis. Inflamm Bowel Dis 2007;13:123-8.
30. Etchevers MJ, Aceituno M, García-Bosch O, Ordás I, Sans M, Ricart E,et al. Risk factors and characteristics of extent progression in ulcerative colitis. Inflamm Bowel Dis 2009;15:1320-5.
31. Torres J, Billioud V, Sachar DB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis as a progressive disease: the forgotten evidence. Inflamm Bowel Dis 2012;18:1356-63.
32. Iglesias-Rey M, Barreiro-de Acosta M, Caamaño-Isorna F, Rodríguez IV, Ferreiro R, et al. Psychological Factors Are Associated with Changes in the Health-related Quality of Life in Inflammatory Bowel Disease. Inflamm Bowel Dis 2014;20:92-102.
33. Schreiber S, Panés J, Louis E, Holley D, Buch M, Paridaens K. Perception gaps between patients with ulcerative colitis and healthcare professionals: an online survey. BMC Gastroenterol 2012;12:108.
34. Barreiro-de Acosta M, Vallejo N, de la Iglesia D, Uribarri L, Baston I, Ferreiro I, et al. Mucosal healing in ulcerative colitis: Do Mayo 0 and 1 scores really have the same prognostic value? A prospective observational cohort study. J Crohns Colitis 2014;8:s-38-39.
