INFECCIÓN POR CLOSTRIDIUM DIFFICILE
Carmen Martos Plasencia 1, Joaquín Rodríguez Sánchez 1, María Adán Alonso 1, Melvyn Peña Gómez 1, Rosario Salmoral Luque 1, José Olmedo Camacho1
1Sección de Aparato Digestivo. Hospital General Universitario de Ciudad Real.
RESUMEN
Introducción. La diarrea por clostridium difficile (C. difficile) supone la causa más frecuente de diarrea hospitalaria en occidente. El amplio uso de antibióticos y el envejecimiento de la población han supuesto los factores más determinantes en el aumento de su incidencia en los últimos años . Los cambios en la epidemiología y el desarrollo de nuevos agentes farmacológicos para su tratamiento, han despertado el interés en la realización de una revisión de la literatura más reciente acerca de la enfermedad.
Materiales y métodos. La revisión se ha llevado a cabo consultando las principales guías de consenso americanas y europeas de diagnóstico y tratamiento de la enfermedad. Para ella se ha realizado también una búsqueda bibliográfica de artículos publicados en la base de datos Pubmed entre los años 1994 y 2014.
Conclusión. La colitis pseudomembranosa es una infección cada vez más incidente. El diagnostico está basado principalmente en la clínica y algoritmos que combinan enzimo-inmunoensayo (ELISA) de GDH y toxinas de C. Difficile. Aunque en los últimos cuatro años se han desarrollado nuevos agentes farmacológicos para su tratamiento como la fidaxomicina, los esquemas de tratamiento continúan centrados en el tratamiento clásico con metronidazol y vancomicin. Debemos intensificar nuestro esfuerzo en la prevención primaria y secundaria de la enfermedad con políticas de uso responsable de antibióticos y establecer medidas para evitar la propagación por contacto de la infección.
PALABRAS CLAVE
Diarrea, antibiótico, Clostridium difficile, colitis pseudomembranosa, metronidazol, vancomicina.
ABREVIATURAS
C. difficile: Clostridium Difficile. IBP: inhibidores de la bomba de protones, AntiH2: antagonistas del receptor H2, IDSA: Sociedad Americana de enfermedades infecciosas , ACG: Colegio Americano de Gastroenterología, ELISA: enzimo-inmunoensayo
INTRODUCCIÓN
La diarrea por C. difficile supone la causa más frecuente de diarrea hospitalaria en países occidentales (1). Es el responsable del 15- 25% de las diarreas que se producen en pacientes consumidores de antibióticos. Su incidencia está estimada entre 3,4–8,4 casos por pacientes hospitalizados en una unidad de agudos. No existen datos concretos acerca de la incidencia de la enfermedad en Hospitales de cuidados intermedios y crónicos pero la edad de los pacientes de estos centros y el consumo antibiótico ampliamente extendido permite prever una incidencia mayor en este medio.(2)
La mortalidad de la enfermedad ronda el 2% de los pacientes que contraen la infección por el bacilo (2). A pesar de contar con datos bajos de mortalidad, la infección por C. difficile supone un aumento en la morbilidad de los pacientes, generando un aumento de los costes directos derivados del tratamiento de la enfermedad que en el año 2008 llegó a calcularse en 4,8 billones de dólares en EEUU. (3)
EPIDEMIOLOGÍA
En los últimos 10 años, se ha producido un aumento de la incidencia de la infección. Entre 2000 y 2005 se documentó este aumento en hospitales estadounidenses y en la región canadiense de Quebec que posteriormente se ha extendido a países europeos. Este incremento está relacionado a la diseminación de la cepa 027/B1/ NAP1. Esta cepa posee mayor virulencia que las conocidas previamente y un espectro de resistencia a quinolonas superior. Aunque se trata de una cepa de alta virulencia, afortunadamente, no se encuentra entre las que producen la enfermedad con más frecuencia. En un estudio multicéntrico publicado en 2009, se definieron los ribotipos más frecuentes siendo éstos el 241, 126 y 078 (4).
FACTORES DE RIESGO
Los factores de riesgo de adquisición de la enfermedad son múltiples pero podemos destacar entre los más importantes los siguientes:
• Consumo de antibióticos
El consumo de antibióticos es el principal y más importante factor de riesgo para el desarrollo de una colitis pseudomembranosa. En ausencia de la flora saprófita, las esporas eclosionadas en el colon pueden crecer sin competencia biológica. Los grupos de fármacos especialmente relacionados con la enfermedad son penicilinas, cefalosporinas, quinolonas y clindamicina.(5) Un 96% de los pacientes que presentan infección sintomática por C. difficile han recibido antibióticos en los 14 días previos a la aparición de diarrea.(6)
• Edad
Existe un mayor riesgo de enfermedad en los mayores de 45 años ; los pacientes mayores de 65 años son los que presentan un riesgo de enfermedad grave más significativo. En estos grupos poblacionales la infección ha experimentado un aumento de la incidencia. (1)
• Hospitalización o institucionalización
Los antibióticos son tratamientos de uso frecuente en los pacientes ingresados. Este hecho junto con la agregación de pacientes, favorece la trasmisión durante los cuidados y exploraciones generando un aumento del riesgo de adquisición de la enfermedad comparativamente con pacientes que presentan diarrea en la comunidad. (7)
• Consumo de inhibidores de la bomba de protones (IBPs)
Existe controversia acerca del papel de la inhibición de la secreción gástrica sobre la infección por CD. En la literatura se han encontrado estudios que se posicionan a favor de la relación de la enfermedad con el consumo de antagonistas del receptor H2 (antiH2) como con IBP (8,9). La relación entre la infección y la supresión, posteriormente fue puesta en duda por cuestiones de la metodología de los estudios o por aparición de factores de confusión (5). En un metanálasis publicado en el año 2012 se demuestra un aumento de la incidencia de diarrea por CD del 65% (OR 1.69 (95% IC 1.39-1.97) p < 0.001.) en los pacientes tratados con IBPs. (10)
• Inmunosupresión: trasplantes, pacientes oncológicos, tratamiento biológico
Actualmente el número de pacientes sometidos a terapia inmunosupresora o quimioterapia hace que la inmunodepresión sea una circunstancia frecuente en la práctica clínica. Estos pacientes presentan mayor facilidad para la adquisición de infecciones comunes y oportunistas derivadas de su propia situación de neutropenia o linfopenia. La situación de inmunosupresión contribuye por sí misma al aumento del riesgo de infección por C. difficile y se combina con el alto consumo de antibióticos de estos pacientes para el tratamiento de las múltiples infecciones que sufren. (7)
• Cirugía abdominal
La manipulación del tracto gastrointestinal así como su exposición a agentes externos en las intervenciones quirúrgicas está relacionado con la aparición de diarrea por CD (11). En paciente con megacolon tóxico portadores de ileostomía está descrita la recurrencia de la infección tras la cirugía (12).
FISIOPATOLOGÍA
En 1978 el C.D fue descrito como el agente causal de la colitis pseudomembranosa. Es un bacilo gram positivo esporulado anaerobio estricto productor de dos toxinas. La toxina A entero tóxica y la toxina B citotóxica, siendo la B la que presenta un papel más importante en la virulencia del Clostridium. La transmisión de la infección se produce fundamentalmente por vía fecal oral. Tras un periodo de incubación de 2-3 días después del contagio se produce una germinación de las esporas ingestas a nivel intestinal. Los bacilos germinados en un ambiente favorecido por la disminución de la flora saprófita van a experimentar un fenómeno de sobrecrecimiento y formación de toxina que actúe sobre el epitelio intestinal produciendo una disrupción de éste, responsable de la clínica de la enfermedad. (2, 4, 13)
MANIFESTACIONES CLÍNICAS
El espectro clínico de la enfermedad es muy amplio. Desde pacientes asintomáticos o con clínica leve, que puede llegar a pasar desapercibida, hasta pacientes con gran repercusión sistémica en los que la infección puede llegar a producir la muerte.
La clínica puede dividirse en síntomas generales presentes en una infección por cualquier germen: afectación del estado general, astenia, debilidad y fiebre y otros síntomas propios de la afectación del tracto gastrointestinal.
La manifestación intestinal más típica es la diarrea, que es de características inflamatoria. El paciente puede llegar a producir mucosidad y sangre con las heces. Sin embargo la hematoquecia o melenas son muy infrecuentes (2). Aunque la diarrea sea frecuente en esta infección, puede no manifestarse. En ocasiones encontramos pacientes con formas graves con íleo o megacolon tóxico que presentaron mínima diarrea o no la presentaron.(2, 13, 14)
El dolor abdominal también es una manifestación frecuente de la enfermedad. Se trata de un dolor abdominal generalizado o localizado en mesogastrio, de curso cólico, producido por la distensión e hipermotilidad de las asas intestinales. Este puede llegar a ser de intensidad elevada en los pacientes que presentan megacolon o sufren una perforación intestinal.
Las náuseas y vómitos pueden acompañar al resto de síntomas generales especialmente en las formas de gravedad moderada o graves con afectación del estado general.
La severidad de la clínica que presentan los pacientes va a ser determinante a la hora de seleccionar el tratamiento que vamos a emplear. Las guías clínicas determinan la gravedad de la enfermedad en función del estado inflamatorio y la existencia de deterioro de la función renal (2,15-17).
Las formas leves o moderadamente graves presentan cifras de leucocitos menores o iguales a 15.000 u/mm3 con niveles de creatinina menores a 1,5 veces el valor basal del paciente.
En las formas graves, podremos observar en la analítica una leucocitosis mayor de 15000 u/mm3 con un deterioro de la función renal que suponga una creatinina en suero mayor de 1,5 veces el valor basal del paciente.
Cuando las formas graves se complican en forma de íleo, megacolon o perforación intestinal el paciente presenta inestabilidad hemodinámica y shock séptico. En 2013 el Colegio Americano de Gastroenterología describe en su guía de práctica clínica las formas graves y complicadas como aquellas en las que aparece: fiebre mayor de 38ºC, hipotensión, distensión abdominal, hipoalbuminemia (albúmina < 3 g/dl), leucocitosis mayor de 35.000 u/mm3, deterioro del estado neurológico, láctico > 2 mmol/l y signos de fallo multiorgánico (16).
TIPOS
Las guías de práctica clínica americanas (2,16) para el manejo clínico de la infección por C. difficile clasifican la enfermedad en tres tipos en función de criterios epidemiológicos de adquisición.
• Diarrea por C. difficile de inicio hospitalario la clínica comienza en el contexto de una estancia hospitalaria tras un periodo mayor de 48 horas.
• Diarrea de inicio en la comunidad asociada a instalación sanitaria el paciente ha estado ingresado en una institución sanitaria en las últimas 4 semanas.
• Diarrea de inicio en la comunidad asociada a la comunidad no se documenta una estancia hospitalaria en más de 12 semanas previas al inicio de la clínica.
• Diarrea por C. difficile indeterminada existe un periodo comprendido entre 4-12 semanas en el que el paciente estuvo en un medio hospitalario.
DIAGNÓSTICO
Se define la infección por C. difficile como un cuadro de diarrea (con 3 ó más deposiciones de heces no formadas en 24 horas) junto con una prueba de heces con resultado positivo para C.difficile toxinogénico, sus toxinas o hallazgos histológicos o endoscópicos compatibles con colitis pseudomembranosa.(2)
El diagnóstico de la colitis pseudomembranosa puede llegar a ser complejo. Para llegar a él es necesario junto con la clínica y las pruebas complementarias una buena anamnesis que nos despierte la sospecha de la enfermedad.
ESTUDIOS COMPLEMEMENTARIOS
LABORATORIO
Actualmente disponemos de varios estudios analíticos para el diagnóstico de confirmación de la diarrea por C. difficile. Los análisis de laboratorio para diagnóstico de C. difficile sólo deben ser llevados a cabo en pacientes sintomáticos.(2,16,17)
Clasicamente, se describe como técnica de referencia el cultivo intracelular y cultivo toxinogénico (2,16,17). El cultivo de heces combinado con el cultivo toxinogénico supone la prueba gold estándar desde el punto de vista epidemiológico para el diagnóstico de la infección (2). El cultivo de heces por sí solo no permite la distinción entre cepas toxinogénicas y no toxinogénicas. Además, sólo deberá realizarse asociado al test de detección de toxina de C. difficile (2,4,16). Estas técnicas a pesar de tener alta sensibilidad y especificidad (sensibilidad > 90% y especificidad > 95%) (4) presentan un largo tiempo de incubación. Por este motivo, en la práctica clínica habitual han sido sustituidos por otras técnicas de diagnóstico indirecto (2,4,16).
Dentro de las técnicas indirectas de diagnóstico contamos principalmente con 2 tipos de determinaciones de enzimo-inmunoensayo (ELISA). Estas técnicas se llevan a cabo en poco tiempo y alcanzan de forma aislada y combinada niveles de sensibilidad y especificidad equiparables al cultivo (4). La técnica más ampliamente extendida es la detección de toxina A y B de C. difficile. El principal problema de esta técnica reside en su sensibilidad (50-85%). Su baja sensibilidad diagnóstica ha justificado la elaboración de algoritmos diagnósticos combinados con la detección de glutamato deshidrogenasa (GDH) de la bacteria (2,4,17).
Los algoritmos diagnósticos de detección combinada establecen el diagnóstico cuando se obtiene un resultado positivo en las determinaciones de GDH y toxina. Cuando la GDH es positiva y la toxina negativa deberá realizarse un tercer test de confirmación. Habitualmente, el test de confirmación suele ser el cultivo con estudio de toxicidad o una técnica molecular para diagnóstico del clostridium (4,16,17).
En el caso de obtener una determinación negativa para GDH con una toxina positiva también precisaremos un test de confirmación. El resultado negativo de los dos test del algoritmo excluye el diagnostico microbiológico de la enfermedad (4, 17).
En los últimos años se han propuesto diferentes técnicas diagnósticas basadas en la detección de ácidos nucleicos de C. difficile (4) Dentro de este grupo de técnicas, la más extendida es la reacción de cadena polimerasa (PCR) para genes de la bacteria (2,4,16,17). La PCR ofrece una alternativa, sensible(> 90%), específica (> 97%) y rápida para el diagnóstico de la enfermedad.(4) Sin embargo, el elevado precio de la técnica y la ausencia de su disponibilidad en todos los centros hacen que no sea una técnica habitualmente utilizada en la práctica clínica.(2,4,16,17)
La realización de los test diagnósticos en pacientes asintomáticos o su repetición tras el tratamiento no está justificada. Así como no está indicado el tratamiento de portadores asintomáticos.(2,16,17)
ESTUDIOS RADIOLÓGICOS
Los estudios de imagen no son necesarios para establecer el diagnóstico de la enfermedad, sin embargo, pueden ayudarnos a diagnosticar las complicaciones secundarias como el ileo paralítico, ascitis, megacolon o perforación intestinal. Ante la sospecha de una de estas complicaciones debe realizarse un TAC abdomino-pélvico. En un paciente con una forma complicada de la enfermedad e indicación quirúrgica, la cirugía no debe ser retrasada por la realización de una prueba de imagen. (2,16)
ENDOSCOPIA
Los estudios endoscópicos no están indicados como una técnica diagnóstica a realizar de inicio en esta enfermedad. Recurriremos a ella en las formas graves, atípicas o diarreas persistentes en los que los datos de laboratorio y análisis microbiológicos no presenten datos concluyentes que orienten y/o confirmen el diagnóstico.(2)
Los hallazgos endoscópicos consisten en placas blanco-amarillentas que se distribuyen de manera irregular a lo largo de la mucosa colónica. El hallazgo endoscópico de pseudomembranas confirma el diagnóstico de colitis pseudomembranosa. Sin embargo, estos hallazgos sólo se visualizan en el 51-55% de los pacientes diagnosticados de diarrea porC.difficile, especialmente, en las formas más graves. Por este motivo, una colonoscopia negativa no excluye el diagnóstico. (2,4)
La principal entidad con la que se debe hacer el diagnóstico diferencial ante unos hallazgos endoscópicos compatibles con colitis pseudomembranosa, es la colitis isquémica, las características del paciente y sus antecedentes personales permiten orientar el diagnóstico de forma sencilla. (4)
Indicaciones de endoscopia:
• Casos graves de rápida evolución.
• Retraso de los resultados de los test de laboratorio.
• Test de laboratorio negativos y clínica persistente.
• Formas atípicas de la enfermedad (ausencia de diarrea, no consumo de antibióticos…).
TRATAMIENTO
Las medidas generales que se aplican en el soporte de un paciente con diarrea no van a diferir de las medidas que aplicaremos en una diarrea por C.difficile. En cuanto a las medidas específicas, la primera a llevar a cabo es la retirada del agente antibiótico que favorece el crecimiento de la bacteria. En las formas leves, esta intervención junto con el soporte general puede ser suficiente para la resolución del cuadro. (2,4,16,18)
En ocasiones se ha propuesto el uso de fármacos probióticos para el tratamiento de las infecciones del tracto gastrointestinal, en el tratamiento de la diarrea por C.difficile no existe suficiente evidencia que apoye su uso en el tratamiento o la prevención de la enfermedad y/o su recurrencia.(2,16,18)
El uso de antiperistálticos ha sido valorado en las guías de tratamiento más importantes, en todas ellas se recomienda evitar su utilización en paciente con diarrea por C.difficile. (2,16,18)
El tratamiento antibiótico en la diarrea por C.difficile se ha basado clásicamente en esquemas a partir de metronidazol o vancomicina (2,4,16, 18). En el año 2011 la FDA aprobó la utilización de la fidaxomicina (16). Un antibiótico macrocíclico no absorbible con actividad bactericida mediante la inhibición de la ARN polimerasa de C.diffile (4,19,20). Sin embargo, aunque ha demostrado no ser inferior a los tratamientos clásicos y mayor efectividad en la recurrencia no ha alcanzado un grado de recomendación equiparable al del tratamiento clásico (4,16,18).
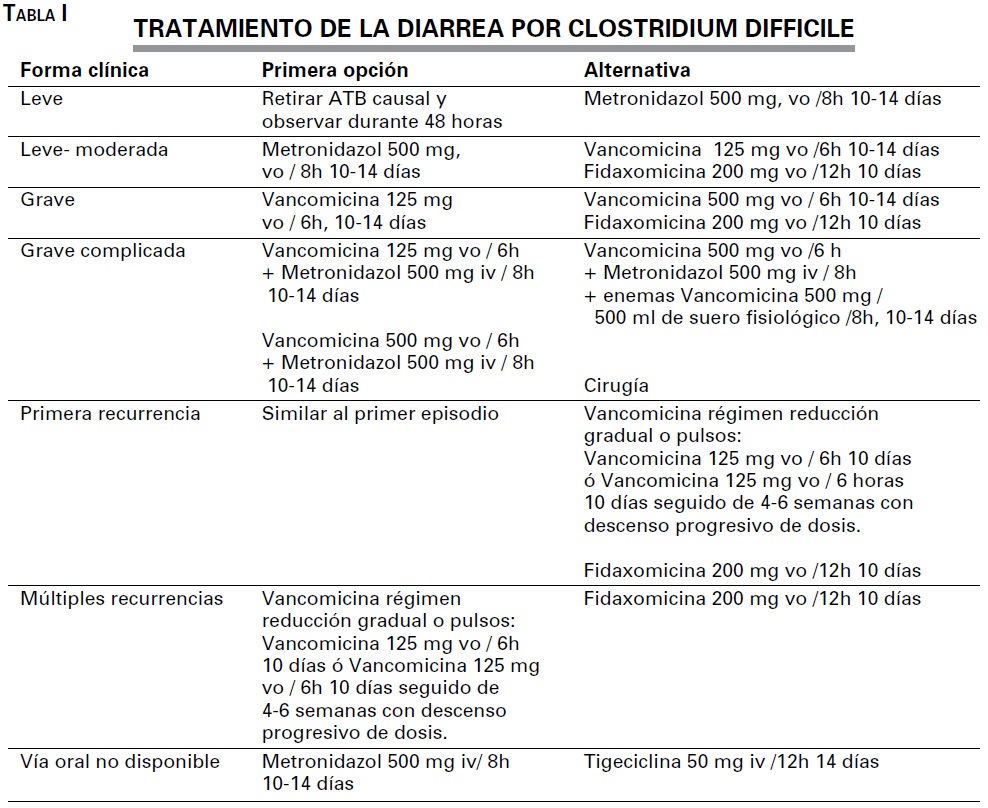
TRATAMIENTO ANTIBIÓTICO DEL PRIMER EPISODIO
1. Formas leves y leve-moderada:
En las formas leves de la diarrea por C.difficile puede ser suficiente con la retirada del antibiótico responsable. En estos casos, se recomienda una observación clínica estrecha durante 48 horas. Si tras 48 horas persiste la clínica deberá iniciarse tratamiento con metronidazol 500 mg vía oral cada 8 horas durante 10- 14 días (2,16,18).
Los pacientes con clínica de gravedad moderada recibirán tratamiento con metronidazol 500 mg cada 8 horas vía oral durante 10-14 días desde el diagnóstico. Como alternativa al metronidazol en pacientes con intolerancia, embarazadas o durante la lactancia utilizarán vancomicina 125 mg vía oral cada 6 horas con la misma duración del tratamiento.(2,16,18)
Cuando tras 5-7 días de tratamiento con metronidazol no obtengamos una respuesta clínica favorable debe valorarse el cambio por vancomicina. (2)
2. Formas graves
Los casos graves de diarrea por C. difficile deben recibir tratamiento con esquemas basados en vancomicina. Las guías de la Sociedad Americana de Enfermedades Infecciosas (IDSA) de 2010 proponían utilizar dosis altas de vancomicina, recomendando 500 mg cada 6 horas vía oral durante 10-14 días (2). Estudios posteriores con dosis menores demuestran que no existe diferencia en cuanto a duración de la diarrea y curación microbiológica. Por este motivo no existe evidencia que apoye la utilización de dosis mayores de 125 mg de vancomicina vía oral cada 6 horas durante 10-14 días en el tratamiento de las formas graves. (16,18)
3. Grave complicada
El tratamiento de las formas graves y complicadas precisa la combinación de varios fármacos administrados simultáneamente por distintas vías de administración. La mayoría de la bibliografía propone emplear tratamiento con vancomicina 500 mg vía oral cada 6 horas junto con metronidazol 500 mg iv cada 8 horas. El tratamiento podría complementarse con enemas con vancomicina a dosis de 500 mg en 500 ml de suero fisiológico cada 8 horas (2,16,18). El Colegio Americano de Gastroenterología(ACG) propone dos posibilidades de tratamiento en esta forma clínica. Recomiendan el tratamiento descrito previamente para pacientes en los que exista distensión abdominal y se muestran algo más conservadores en pacientes con una forma grave moderada sin distensión abdominal. En este grupo de pacientes, proponen vancomicina 125 mg cada 6 horas vía oral junto con metronidazol 500 mg iv cada 8 horas. (16)
4. Pacientes con imposibilidad
de uso de vía oral
En los pacientes en los que no pueda emplearse la vía oral el uso de vancomicina carece de utilidad. Al tratarse de un fármaco con una excreción principalmente renal cuando se administra por vía intravenosa no se consigue concentraciones suficientes a nivel del colon para la erradicación del bacilo. Por esta razón, el tratamiento de la infección en paciente que no toleran la vía oral se realiza con metronidazol 500 mg intravenoso cada 8 horas. En los pacientes que presentan íleo paralítico puede aceptarse la utilización de vancomicina en enemas aunque no es una práctica estandarizada. (2,16,18)
En algunas series de casos se han obtenido buenos resultados con el empleo de tigeciclina iv en pacientes con formas graves en los que no se consigue respuesta satisfactoria con tratamiento intravenoso con metronidazol. De esta manera, se evita la necesidad de tratamiento quirúrgico en estos pacientes. (21)
TRATAMIENTO DE LA RECURRENCIA
La recurrencia de la diarrea por C. difficile se define como la reaparición de la clínica tras la retirada del tratamiento habiendo desaparecido esta durante el mismo. (2) El tratamiento de la recurrencia será diferente en función del número de episodios que presente el paciente.
1. Recurrencia única
Las guías IDSA de 2010 y el ACG proponen como tratamiento de la primera recurrencia un nuevo ciclo del fármaco administrado en el primer episodio utilizando como alternativa vancomicina vía oral (2,16).
En Europa se recomienda el uso de vancomicina 125 mg cada 6 horas o fidaxomicina 200 mg cada 12 horas para el tratamiento de la primera recurrencia. Se ha demostrado que el tratamiento con fidaxomicina es similar en eficacia presentando un menor riesgo de recurrencia posterior que con vancomicina.(19,20) Actualmente, en Europa se considera la primera opción terapéutica en la primera recurrencia aunque todavía existen pocos estudios que apoyen su uso de manera generalizada (16,18).
2. Recurrencia múltiple:
Cuando se producen varios episodios de recurrencia se recomienda realizar un tratamiento prolongado. Generalmente este tratamiento se basa en vancomicina 125 mg vía oral administrada en pulsos o en pauta descendente durante varias semanas. En la literatura europea se recomienda el tratamiento de la recurrencia múltiple con fidaxomicina 200 mg vía oral cada 12 horas durante 10 días con un grado de recomendación similar al de los esquemas a partir de vancomicina. (16,19, 20)
El ACG propone la utilización de trasplante de microbiota fecal con un grado de recomendación moderado en casos de diarrea por C.difficile. Este tratamiento estaría reservado para casos con múltiple recurrencia que no han respondido a antibioterapia con pulsos de vancomicina. Su indicación se basa en la hipótesis de la existencia de un desequilibrio en la flora nativa de los pacientes.(16) En las guías europeas de tratamiento publicadas en marzo de 2014 se revisa la indicación de esta medida que en ediciones anteriores no recomendaba.(22). Sin embargo, en su versión más reciente se recomienda el trasplante fecal junto con el tratamiento con un glicopeptido oral como una medida altamente eficaz para los casos que han recurrido en múltiples ocasiones.(18)
La utilización de inmunoglobulinas, especialmente gammaglobulinas, han sido analizadas en algunas series de casos valoradas en las guías de práctica clínica. A día de hoy, no existe evidencia suficiente para recomendar su uso en el tratamiento o prevención de la diarrea por C. difficile o su recurrencia. (2,16,18)
TRATAMIENTO QUIRÚRGICO
Los pacientes que presentan afectación sistémica que no responde al tratamiento médico, peritonitis, megacolon tóxico o perforación colónica van a precisar tratamiento quirúrgico (2,16,18). La cirugía consiste generalmente en practicar una colectomía subtotal.(2) El riesgo quirúrgico que presentan estos pacientes y la mortalidad derivada de la cirugía es mayor que en aquellos que son sometidos a la misma técnica sin la infección.(23) Sin embargo, la mortalidad en los pacientes con formas graves en los que se retrasa la cirugía, es mayor que en aquellos que se someten a cirugía de forma precoz. (23) Durante el manejo de pacientes con formas complicadas de la enfermedad el contacto entre clínico y cirujano debe ser estrecho con el fin de indicar la cirugía en los casos en los que sea necesaria.
Como alternativa a la colectomía subtotal se ha propuesto en los estudios publicados recientemente, la realización de una ileostomía de protección y administración tópica de tratamiento antibiótico como alternativa a la resección completa de colon. (24)

MEDIDAS PREVENTIVAS
La infección por C. difficile es una infección mayoritariamente hospitalaria. Por este motivo los profesionales sanitarios debemos esforzarnos en evitar el desarrollo y la transmisión de la infección en nuestra práctica diaria.
Para evitar la adquisición de la infección es necesario un control estricto del uso de antibióticos.(2,4,16) Los hospitales que cuentan con protocolos de uso racional de antibioterapia presentan una menor incidencia de la infección. Los sistemas de notificación y monitorización de los casos durante las epidemias permiten identificar a los pacientes y tratarlos precozmente.(16)
La principal medida para evitar la propagación de la enfermedad consiste en el lavado de manos y fómites en contacto con el paciente infectado; utilizando siempre que sea posible material desechable en los cuidados de los pacientes infectados. (2,4,16) El lavado de manos debe llevarse a cabo con agua y jabón ya que las soluciones alcohólicas no garantizan la eliminación de las esporas del bacilo. (2) La desinfección de las superficies del entorno en el que se encuentra el paciente deben realizarse con soluciones esporicidas o en su defecto con agentes de limpieza con una concentración de 5000 ppm de cloro (16).
El paciente debe permanecer ingresado en una habitación individual siempre que sea posible. En el caso de que no tengamos disponible una habitación individual intentaremos agrupar a los pacientes infectados por el mismo patógeno. (2)
El personal sanitario y no sanitario así como los acompañantes del paciente deberán realizar medidas preventivas que eviten la contaminación durante el contacto con el paciente. El uso de guantes y bata es suficiente para evitar la propagación por contacto de la enfermedad. Las medidas de aislamiento deben mantenerse como mínimo hasta la resolución de la diarrea. (2,16)
CONCLUSIONES
• La diarrea por clostridium difficile supone la causa más frecuente de diarrea en el medio hospitalario(1) favorecido por el consumo de antibióticos y la edad (2,4).
• El diagnostico está basado principalmente en la clínica y algoritmos que combinan ELISA de GDH y toxinas de C. difficile. Contamos con técnicas diagnósticas que a pesar de ser muy sensibles en la práctica clínica habitual van a estar en un segundo plano debido al elevado tiempo de incubación que precisan. (2,4,16,17)
• Los estudios endoscópicos y de imagen serán especialmente útiles en los casos graves o las presentaciones atípicas de la enfermedad. (2,16,17)
• El tratamiento de la enfermedad se basa principalmente en la retirada de agente antimicrobiano causal y la antibioterapia con metronidazol o vancomicina oral según la gravedad del cuadro (2,16,18). Para el tratamiento de la recurrencia de la infección contamos con nuevos antibióticos como la fidaxomicina.(16,18)
• En los casos graves y complicados con afectación sistémica está indicada la colectomía subtotal.(2,16,18) El retraso en la indicación del tratamiento quirúrgico supone un aumento de la mortalidad (23).
• La principales medidas preventivas consisten en el uso responsable de antibióticos y el aislamiento de los pacientes hasta la desaparición de la diarrea.(2,4,16)
BIBLIOGRÁFICAS
1. He M, Miyajima F, Roberts P, Ellison L, Pickard DJ, Martin MJ, et al. Emergence and global spread of epidemic healthcare-associated Clostridium difficile. Nature Genetics 2013;45(1):109-13.
2. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, L Clifford McDonald M, et al. Guías de práctica clinica para la infección por Clostridium difficile en adultos: actualización 2010 realizada por la Sociedad de Salud Epidemiológica de Norteamérica (SHEA) y la Sociedad de Enfermedades Infecciosas de Norteamérica (IDSA). Infection Control and Hospital Epidemiology 2010;31(5):T1-T28.
3. Depestel DD, Aronoff DM. Epidemiology of Clostridium difficile infection. Journal of Pharmacy Practice. 2013;26(5):464-75.
4. Rodriguez-Pardo D, Mirelis B, Navarro F. [Infections caused by Clostridium difficile]. Enfermedades Infecciosas y Microbiología Clínica 2013;31(4):254-63.
5. Loo VG, Poirier L, Miller MA, Oughton M, Libman MD, Michaud S, et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mortality. The New England Journal of Medicine 2005;353(23):2442-9.
6. Olson MM, Shanholtzer CJ, Lee JT, Jr., Gerding DN. Ten years of prospective Clostridium difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982-1991. Infection Control and Hospital Epidemiology (the official journal of the Society of Hospital Epidemiologists of America 1994;15(6):371-81
7. Sunenshine RH, McDonald LC. Clostridium difficile-associated disease: new challenges from an established pathogen. Cleveland Clinic Journal of Medicine 2006;73(2):187-97.
8. Dial S, Delaney JA, Barkun AN, Suissa S. Use of gastric acid-suppressive agents and the risk of community-acquired Clostridium difficile-associated disease. Jama 2005;294(23):2989-95.
9. Dial S, Alrasadi K, Manoukian C, Huang A, Menzies D. Risk of Clostridium difficile diarrhea among hospital inpatients prescribed proton pump inhibitors: cohort and case-control studies. CMAJ: Canadian Medical Association Journal (journal de l’Association medicale canadienne) 2004;171(1):33-8
10. Janarthanan S, Ditah I, Adler DG, Ehrinpreis MN. Clostridium difficile-associated diarrhea and proton pump inhibitor therapy: a meta-analysis. The American Journal of Gastroenterology 2012;107(7):1001-10.
11. Damle RN, Cherng NB, Flahive JM, Davids JS, Maykel JA, Sturrock PR, et al. Clostridium difficile Infection After Colorectal Surgery: A Rare but Costly Complication. Journal of Gastrointestinal Surgery (official journal of the Society for Surgery of the Alimentary Tract) 2014;18(10):1804-11.
12. Seril DN, Ashburn JH, Lian L, Shen B. Risk Factors and Management of Refractory or Recurrent Clostridium difficile Infection in Ileal Pouch Patients. Inflammatory Bowel Diseases 2014.
13. Kelly CP, LaMont JT. Clostridium difficile–more difficult than ever. The New England Journal of Medicine 2008;359(18):1932-40.
14. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile colitis. The New England Journal of Medicine 1994;330(4):257-62.
15. Iv EC, Iii EC, Johnson DA. Clinical update for the diagnosis and treatment of Clostridium difficile infection. World Journal of Gastrointestinal Pharmacology and Therapeutics 2014;5(1):1-26.
16. Surawicz CM, Brandt LJ, Binion DG, Ananthakrishnan AN, Curry SR, Gilligan PH, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. The American Journal of Gastroenterology 2013;108(4):478-98; quiz 99.
17. Crobach M, Dekkers O, Wilcox M, Kuijper E. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): Data review and recommendations for diagnosing Clostridium difficile infection (CDI). Clinical Microbiology and Infection 2009;15(12):1053-66.
18. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clinical Microbiology and Infection (the official publication of the European Society of Clinical Microbiology and Infectious Diseases) 2014;20 Suppl 2:1-26.
19. O’Horo J, Jindai K, Kunzer B, Safdar N. Treatment of recurrent Clostridium difficile infection: a systematic review. Infection 2014;42(1):43-59.
20. Louie TJ, Miller MA, Mullane KM, Weiss K, Lentnek A, Golan Y, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. New England Journal of Medicine 2011;364(5):422-31.
21. Herpers BL, Vlaminckx B, Burkhardt O, Blom H, Biemond-Moeniralam HS, Hornef M, et al. Intravenous tigecycline as adjunctive or alternative therapy for severe refractory Clostridium difficile infection. Clinical Infectious Diseases 2009;48(12):1732-5
22. Bauer M, Kuijper E, Van Dissel J. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clinical Microbiology and Infection 2009;15(12):1067-79.
23. Bhangu A, Nepogodiev D, Gupta A, Torrance A, Singh P. Systematic review and meta analysis of outcomes following emergency surgery for Clostridium difficile colitis. British Journal of Surgery 2012;99(11):1501-13.
24. Stewart D, Hollenbeak C, Wilson M. Is colectomy for fulminant Clostridium difficile colitis life saving? A systematic review. Colorectal Disease 2013;15(7):798-804.
CORRESPONDENCIA:
Dra. Carmen Martos Plasencia.
Sección de Aparato Digestivo.
Hospital General Universitario de Ciudad Real.
Calle Obispo Rafael Torija s/n • 13005 Ciudad Real.
Telf: 926 278 000 – Ext (79606).
