Adalimumab en el tratamiento de la colitis ulcerosa: una revisión crítica
María Chaparro y Javier P. Gisbert.
Hospital Universitario de La Princesa. Instituto de Investigación Sanitaria Princesa (IIS-IP).
Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD).
Correspondencia:
María Chaparro, MD.
Americio 17, portal E 2ºC.
28021 Madrid. Spain.
Tel.: 34-913093911; Fax: 34-914022299
E-mail: mariachs2005@gmail.com
RESUMEN
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal crónica que afecta al colon. El adalimumab ha demostrado ser eficaz en la inducción y el mantenimiento de la remisión en los pacientes con CU moderada-grave, siendo la magnitud de su efecto probablemente mayor en la práctica clínica que lo descrito en los ensayos clínicos. Además, el tratamiento con este fármaco permite disminuir la tasa de hospitalizaciones en los pacientes con CU moderada-grave. Ninguno de los anti-TNFa parece ser más eficaz que los otros en el tratamiento de la CU, por lo que la elección de uno u otro debe basarse en otros factores, como la vía de administración o la preferencia del paciente. Sin embargo, adalimumab, al igual que el golimumab, no ha sido evaluado en el caso de la CU grave corticorrefractaria, por lo que se desconoce su papel en esta situación clínica. Por otro lado, el tratamiento con adalimumab es seguro, pudiendo ser tolerado incluso por los pacientes que presentaron acontecimientos adversos con infliximab. La medición de los niveles de adalimumab podría ayudar a optimizar el tratamiento. No obstante, los datos sobre su utilidad en la CU son aún muy limitados. La relación coste-eficacia del tratamiento de la CU con anti-TNFa, incluido el adalimumab, es controvertida.
Abreviaturas: CU, colitis ulcerosa; anti-TNFa, fármacos contra el factor de necrosis tumoral a; AVAC, años de vida ajustados por calidad.
Palabras clave: Colitis ulcerosa, biológicos, adalimumab, infliximab, golimumab, anti-TNFa.
INTRODUCCIÓN
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal crónica que afecta al colon. Aunque su etiología es desconocida, se ha sugerido que podría tener un origen multifactorial, consecuencia de la acción de factores ambientales que originarían la activación crónica del sistema inmune en individuos genéticamente predispuestos. Desde el punto de vista clínico, la CU se caracteriza por la aparición de brotes de inflamación intercalados con periodos de remisión 1.
En la actualidad no existe un tratamiento médico curativo para la CU. Tradicionalmente, se había propuesto la colectomía total como un tratamiento teóricamente curativo al extirpar el colon se evitaría la aparición de nuevo brotes de inflamación. Sin embargo, la morbimortalidad que se asocia a este procedimiento hace que en la actualidad el tratamiento quirúrgico quede reservado para aquellos pacientes que presenten refractariedad o intolerancia al tratamiento médico o bien complicaciones graves como el megacolon tóxico, displasia o carcinoma colorrectal 2.
Por tanto, el tratamiento médico es la piedra angular del manejo de la CU y su objetivo es controlar la inflamación para que los pacientes puedan llevar una vida normal. La elección del fármaco depende de la extensión de la enfermedad, de la gravedad del brote y de los tratamientos previos 1. Los aminosalicilatos son el tratamiento de primera línea en la CU leve-moderada. En el caso de que el paciente no responda a estos fármacos y en el caso de brotes moderados-graves, los esteroides continúan siendo el tratamiento de primera elección. En los casos en los que no haya respuesta a los corticoides o que los inmunosupresores sean insuficientes para mantener la remisión, estarían indicados los fármacos contra el factor de necrosis tumoral a (anti-TNFa) 1.
El TNFa es una citocina proinflamatoria que tiene un papel destacado en la patogenia de la enfermedad inflamatoria intestinal 3; aunque inicialmente el papel del TNFa no estaba tan establecido como en la enfermedad de Crohn, se ha descrito que esta citocina también se encuentra en concentraciones elevadas en el suero, la mucosa de colon y en las heces de los pacientes con CU 4-6. Además, el infliximab, que es un anticuerpo monoclonal contra el TNFa, ha demostrado su eficacia en la inducción y el mantenimiento de la remisión en pacientes con CU 7.
El adalimumab es una inmunoglobulina recombinante humana IgG1 que se une específicamente al TNFa, tanto soluble como de membrana, y bloquea su interacción con las subunidades p55 y p75 de los receptores transmembrana del TNFa. Es el primer anticuerpo anti-TNFa monoclonal enteramente humano y fue aprobado para el tratamiento de la artritis reumatoide por la Food and Drug Administration en 2002 y por la European Medicines Agency en 2003. En abril de 2012 se aprobó en Europa para el tratamiento de pacientes con CU de moderada a grave con una respuesta inadecuada a los tratamientos convencionales.
En el presente artículo revisaremos críticamente la evidencia sobre la eficacia del adalimumab en el tratamiento de la CU, su efecto en la prevención de la colectomía, la importancia de los niveles séricos del fármaco en la respuesta al tratamiento, así como algunos datos sobre la eficiencia de este fármaco.
EFICACIA DEL ADALIMUMAB ENEL TRATAMIENTO DE LA CU: LA EVIDENCIA DE LOS ENSAYOS CLÍNICOS
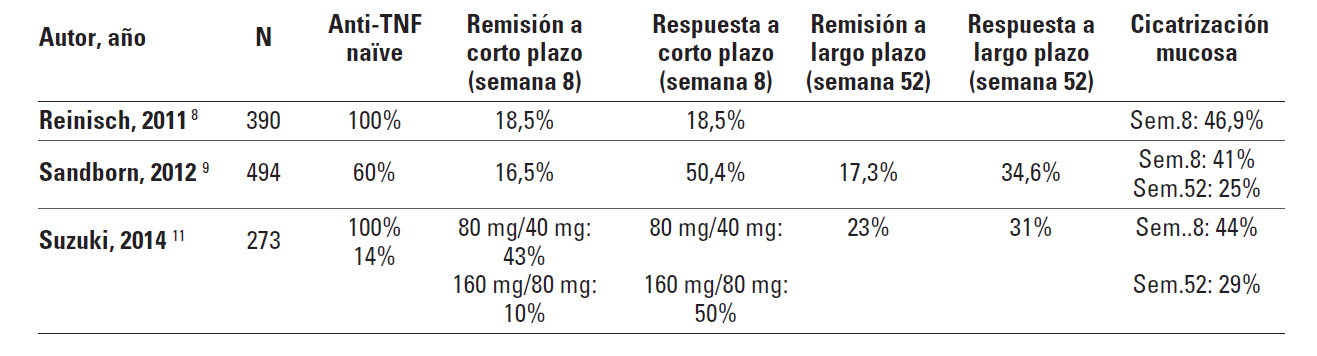
Los estudios clave que han evaluado la eficacia del adalimumab en la CU son los ULTRA 1 y 2 (Tabla I) 8-9. El estudio ULTRA 1 es un ensayo clínico aleatorizado, doble ciego, controlado con placebo 8 que consta de una primera fase de 8 semanas en la que se evaluó la respuesta a la inducción y, posteriormente, un seguimiento de 52 semanas. El estudio ULTRA 2 tiene un diseño similar, con una fase de inducción y, posteriormente, otra de mantenimiento durante 52 semanas 9. La diferencia entre estos estudios estriba en que la fase de mantenimiento fue abierta (todos los pacientes recibieron adalimumab) en el ULTRA 1 y ciega (aleatorizada y controlada con placebo) en el ULTRA 2.
El estudio ULTRA 1 incluyó a pacientes con CU de moderada a grave sin respuesta al tratamiento con corticoides e inmunosupresores que fueron asignados mediante aleatorización a 3 ramas de tratamiento: adalimumab 160/80 mg (160 mg en la semana 0, 80 en la semana 2 y 40 en las semanas 4 y 6), adalimumab 80/40 mg (80 mg en la semana 0 y 40 en las semanas 2, 4 y 6) y placebo. El porcentaje de pacientes que alcanzó la remisión en la semana 8 (objetivo primario) fue significativamente mayor en el grupo que recibió la dosis más alta de adalimumab (160/80 mg) que en el grupo placebo (18,5 frente a 9,2%, p=0,031), pero la eficacia resultó similar en el grupo que recibió la dosis de 80/40 mg respecto al placebo (10 frente a 9,2% p=ns).
Eficacia del adalimumab en la colitis ulcerosa: resultados de los ensayos clínicos.

TABLA I
En el estudio ULTRA 2, a diferencia del ULTRA 1, el 40% de los pacientes había estado expuesto previamente a infliximab. En este caso se excluyó la rama de tratamiento con la dosis baja de adalimumab, por lo que los pacientes fueron aleatorizados a recibir tratamiento con adalimumab 160/80 mg en las semanas 0 y 2 y, posteriormente, 40 mg cada 2 semanas o placebo durante 52 semanas. El porcentaje de pacientes que alcanzó la remisión en la semana 8 (objetivo primario) fue estadísticamente superior en el grupo tratado con adalimumab que en el que recibió placebo (16,5 frente a 9,3%, p=0,019); estas diferencias también se mantuvieron en la semana 52 (objetivo primario) entre el grupo tratado con adalimumab y el tratado con placebo (17,3 frente a 8,5%, p=0,004).
Las tasas de remisión alcanzadas con adalimumab fueron significativamente más altas en los pacientes naïve a los anti-TNFa que en los que habían recibido previamente tratamiento con estos fármacos. En este sentido, en los pacientes naïve a los anti-TNFa el porcentaje que logró la remisión en la semana 8 entre los tratados con adalimumab y los que recibieron placebo fue del 21,3 frente al 11%, respectivamente, y en la semana 52 del 22 frente al 12,4%, respectivamente. En el grupo en el que había fracasado previamente al tratamiento anti-TNFa, el porcentaje que alcanzó la remisión en la semana 8 fue similar en el grupo tratado con adalimumab y con placebo (9,2 frente al 6,9%, p=0,5); únicamente se observaron diferencias en el tratamiento de mantenimiento con este fármaco (10,2 frente al 3%, p=0,03). Adalimumab resultó más eficaz que el placebo en alcanzar los objetivos secundarios (respuesta y cicatrización mucosa) en el grupo de pacientes que no habían estado expuestos previamente a anti-TNFa; sin embargo, no hubo diferencias entre el grupo tratado con adalimumab y con placebo en la obtención de respuesta y en la inducción de la cicatrización de la mucosa en los que había fracasado previamente el tratamiento con anti-TNFa.
Finalmente, los pacientes que completaron los estudios ULTRA 1 y ULTRA 2 fueron incluidos en un estudio abierto de extensión (ULTRA 3)10. Los pacientes que recibían adalimumab semanal mantuvieron la misma dosis. Los pacientes que recibían tratamiento ciego y los que recibían adalimumab cada dos semanas iniciaron en este estudio tratamiento con adalimumab cada 2 semanas. En la semana 60 de este estudio de extensión, aproximadamente el 60% de los pacientes estaban en remisión clínica10.
Recientemente se han publicado los resultados de un ensayo clínico realizado en pacientes japoneses con el objetivo de comparar su eficacia y seguridad con los comunicados en los estudios occidentales11. Se incluyeron 273 pacientes con CU refractarios a corticoides, inmunosupresores o a ambos y se aleatorizaron a recibir 3 ramas de tratamiento: adalimumab 160 mg/80 mg en las semanas 0 y 2, y 40 mg cada dos semanas hasta la semana 52; o adalimumab 80 mg/40 mg en las semanas 0 y 2, y 40 mg cada dos semanas hasta la semana 52; o placebo. En la semana 8 el porcentaje de pacientes en remisión fue similar en los 3 grupos de tratamiento; el porcentaje de respuesta y cicatrización mucosa fue significativamente más alto en el grupo tratado con adalimumab 160 mg/80 mg que en el que recibió placebo. Con respecto al mantenimiento, el porcentaje de remisión, respuesta y cicatrización mucosa en la semana 52 fue significativamente más alto en los pacientes que recibieron adalimumab 40 mg cada 2 semanas que en los que fueron tratados con placebo11.
Efectividad del adalimumab en la colitis ulcerosa: resultados de los estudios observacionales.

TABLA II
Los autores de estos estudios concluyeron que el adalimumab a dosis de 160/80 mg en la inducción seguidos de 40 mg cada 2 semanas en el mantenimiento es eficaz en el tratamiento de la CU. No obstante, la modesta diferencia con placebo en las variables de eficacia analizadas plantearon una serie de cuestiones. Por un lado, cabría preguntarse si dosis más altas de adalimumab hubieran sido más eficaces en la CU. A diferencia de lo que ocurrió en los estudios ACT 1 y 2 con infliximab, en los que la dosis más alta evaluada (10 mg/kg) no fue superior a la dosis más baja (5 mg/kg), en el caso del adalimumab la dosis más alta (160 mg/80 mg) sí fue más eficaz que la dosis más baja (80 mg/40 mg); por tanto, se desconoce si una dosis más alta de adalimumab en la inducción habría permitido obtener mejores resultados 7. Además, no se ha evaluado si una dosis más elevada en el mantenimiento, por ejemplo 40 mg/semana, se asocia con una mayor respuesta. Previamente, el estudio de dosis en la enfermedad de Crohn no había mostrado diferencias entre las de mantenimiento de 40 mg/2 semanas y 40 mg/semana, por lo que esta pauta no se ensayó en la CU12.
Por otro lado, la eficacia de adalimumab en la inducción se evaluó de forma muy precoz, en la semana 8. En los pacientes que fueron aleatorizados a recibir adalimumab, la tasa de remisión en la semana 8 fue superior a la descrita en la semana 6, indicando que algunos pacientes que aún no habían obtenido la remisión en esta visita la alcanzaron posteriormente. Sin embargo, el porcentaje de remisión en el grupo placebo fue similar en las semanas 6 y 8. Estos hallazgos hacen pensar que probablemente habría que esperar más tiempo para valorar la eficacia del adalimumab en la inducción de la remisión y que probablemente, de haberse evaluado la respuesta más tardíamente, se hubieran encontrado mayores diferencias con el placebo. En la actualidad se está llevando a cabo un estudio que evalúa el beneficio de dosis más altas de adalimumab para la inducción de la remisión y el mantenimiento de la misma en la CU y que tratará de dar respuesta a estas cuestiones.
EFECTIVIDAD DEL ADALIMUMAB ENLA CU: RESULTADOS DE LA PRÁCTICA CLÍNICA
Si bien la evaluación de los fármacos en los ensayos clínicos es fundamental para conocer su eficacia, existen limitaciones que hacen que los resultados no sean completamente extrapolables a lo que ocurre en la práctica clínica. En primer lugar, los criterios de inclusión de los ensayos clínicos llevan a seleccionar a pacientes en general más jóvenes, sin patologías asociadas a la enfermedad en estudio y, en ocasiones, menos refractarios a los tratamientos. Además, generalmente no se permiten algunos tratamientos concomitantes que pueden ser considerablemente eficaces, como la mesalacina tópica en la CU, u otros fármacos que pudieran tener un efecto sinérgico con el tratamiento evaluado. Finalmente, el tiempo de seguimiento en los ensayos clínicos es limitado y, en la mayoría de los casos, no aportan información sobre la seguridad y la eficacia más allá del año de tratamiento. Por todas estas razones, los datos de los estudios observacionales son fundamentales para conocer la efectividad y seguridad de los fármacos en la vida real. En la Tabla II se resumen los estudios publicados que evalúan la eficacia del adalimumab en la CU en la práctica clínica13-21.
Peyrin-Biroulet et al. presentaron por primera vez en 2007 los datos de 10 pacientes con CU que habían presentado respuesta parcial, pérdida de respuesta o intolerancia al infliximab y que, posteriormente, recibieron adalimumab para la inducción de la remisión. Dos años más tarde, en 2009, Afif et al. publicaron una serie en la que, por primera vez, se incluyeron pacientes con CU tratados con adalimumab que no habían sido expuestos previamente al infliximab. Aproximadamente el 50% de los pacientes presentó respuesta en la semana 24. Es de destacar que los autores no observaron diferencias en las tasas de remisión, respuesta y cicatrización mucosa en función de que los pacientes hubieran estado o no expuestos previamente al tratamiento anti-TNFa. Todos los pacientes toleraron el tratamiento, incluyendo aquellos que habían suspendido el infliximab por reacciones infusionales.
En 2010, Gies et al. evaluaron la eficacia de adalimumab e infliximab en una cohorte de 53 pacientes con CU16. Todos los pacientes incluidos habían fracasado o habían sido intolerantes a los tratamientos convencionales con mesalacina, esteroides e inmunosupresores, pero ninguno había recibido previamente tratamiento anti-TNFa. En esta serie, 28 pacientes recibieron infliximab (5 mg/kg en las semanas 0, 2 y 6 y, posteriormente, cada 8 semanas) y 25 pacientes fueron tratados con adalimumab (160/80 mg en las semanas 0 y 2 y, posteriormente, 40 mg cada 2 semanas). En la semana 14, la tasa de respuesta fue similar entre los tratados con infliximab y adalimumab; del mismo modo, la duración de la respuesta a largo plazo (mediana 54 semanas) fue similar en ambos grupos16.
En 2012 se publicó un estudio multicéntrico español que incluyó a 30 pacientes con CU que habían fracasado al tratamiento previo con anti-TNFa 17. El 10% de los pacientes alcanzó la remisión en la semana 4 y el 27% en la semana 12; el 50% de los pacientes interrumpió el tratamiento por no responder inicialmente o por pérdida de eficacia en una mediana de seguimiento de 48 semanas. Los autores observaron que la falta de respuesta en la semana 12 se asoció con una mayor probabilidad de interrumpir el tratamiento, sugiriendo que no sería beneficioso mantenerlo en aquellos pacientes que no han respondido después de 3 meses. En este estudio, 4 de los pacientes recibieron adalimumab por CU grave corticorrefractaria; ninguno de ellos respondió al tratamiento17.
Más recientemente, García-Bosch et al. analizaron la experiencia del tratamiento con adalimumab en pacientes con CU en un estudio multicéntrico español con datos procedentes del registro ENEIDA20. En este estudio, el tiempo de seguimiento fue más largo que en los previos, con una mediana de tratamiento de 107 semanas. Se incluyeron 48 pacientes, de los cuales el 81% había recibido tratamiento previo con infliximab. El porcentaje de pacientes en remisión fue del 50%, 34% y 30% a las 12, 28 y 54 semanas de tratamiento. Los autores observaron que el haber respondido previamente al tratamiento con infliximab era la única variable predictora de respuesta al adalimumab en la semana 12. Al final del seguimiento (206 semanas), el 44% de los pacientes continuaban en tratamiento con adalimumab. El 37% de los pacientes intensificó el tratamiento a 40 mg/semana, y de ellos el 85% respondió (el 44% alcanzando de nuevo la remisión). El 23% de los pacientes requirió someterse a colectomía tras una media de 205 días. El haber respondido al adalimumab en la semana 12 fue el único factor que se asoció con un menor riesgo de colectomía20.
Finalmente, en 2013 Armuzzi et al. publicaron el estudio con el mayor número de pacientes hasta la fecha que ha evaluado la eficacia del adalimumab en la CU en la práctica clínica21. Se incluyeron 88 pacientes, de los cuales el 78% habían recibido previamente infliximab. El porcentaje de pacientes que alcanzó la remisión aumentó progresivamente a lo largo del seguimiento, siendo del 17%, 28%, 36% y 43% en las semanas 4, 12, 24 y 54, respectivamente. El porcentaje de pacientes que presentó remisión sostenida (remisión tanto en la semana 12 como en la 24 y en la 54) fue del 17%. Finalmente, el 25% de los pacientes fueron sometidos a colectomía por fracaso del tratamiento médico. El porcentaje de colectomía fue más elevado en los pacientes que habían recibido tratamiento previo con infliximab (29 vs. 10%), si bien las diferencias no alcanzaron la significación estadística. En el análisis multivariante, haber alcanzado la remisión clínica y tener niveles bajos de PCR en la semana 12 se asociaron con una mayor probabilidad de remisión a largo plazo, mientras que haber recibido tratamiento previo con inmunosupresores se asoció con una menor probabilidad de remisión en la semana 54 21.
En general, los resultados del tratamiento con adalimumab en la CU en los estudios observacionales muestran un mayor beneficio que en los ensayos clínicos. Se han sugerido diversas causas que podrían explicar estas diferencias. En primer lugar, en los estudios de práctica clínica la evaluación de la actividad generalmente se basa únicamente en la impresión del médico, mientras que en los ensayos clínicos suele emplearse un índice de actividad validado, más estricto. En segundo lugar, el momento de valoración de la respuesta a la inducción es más precoz en los ensayos clínicos (semana 8) y más tardío en los estudios observacionales (semana 12). Por otra parte, el diseño de los estudios de práctica clínica no permite la modificación de las dosis de los tratamientos concomitantes y, en muchos casos, tampoco la administración de mesalacina rectal, muy eficaz en la CU. Sin embargo, en la práctica clínica se optimizan los esquemas terapéuticos para que el paciente reciba todos aquellos fármacos que pudieran tener un efecto sinérgico. Por otro lado, en los estudios de práctica clínica se permite el incremento de la dosis de adalimumab para mantener la respuesta, mientras en los ensayos clínicos la necesidad de incremento de la dosis se considera fracaso. Finalmente, para el análisis estadístico en los estudios ULTRA se consideran como fracasos del tratamiento aquellas visitas de las que no había información, lo que penaliza los resultados del tratamiento en estudio. En la práctica clínica, en general, los valores perdidos no contabilizan para el análisis estadístico.
¿ES EFICAZ EL TRATAMIENTO CONADALIMUMAB A LARGO PLAZO EN LA CU? ¿CUÁNTO DURA LA RESPUESTA EN EL CASODE QUE LA HAYA?
La experiencia sobre la eficacia del adalimumab en la CU a largo plazo, más allá de un año, es aún limitada. A los pacientes que completaron los estudios ULTRA 1 y ULTRA 2 se les ofreció entrar en el estudio de extensión ULTRA 3, y estos pacientes fueron seguidos durante 4 años10. De los pacientes que estaban en remisión en el momento de la inclusión en el estudio ULTRA 3, el 63,6% mantenía la remisión 3 años más tarde; de aquellos que presentaban cicatrización mucosa a la inclusión, el 60% la mantenía a los 3 años. Por otro lado, el 20,4% de los pacientes requirieron aumento de la dosis de adalimumab para mantener la respuesta a lo largo del seguimiento. La presencia de concentraciones bajas de albúmina y niveles altos de PCR se asociaron con un mayor riesgo de pérdida de respuesta a largo plazo. La tasa de hospitalizaciones y colectomías fueron muy bajas a lo largo del seguimiento (0,09 y 0,01 pacientes-año, respectivamente), incluso más bajas que en los estudios ULTRA 1 y 2 10. No obstante, este dato no es de extrañar, ya que en este caso no había grupo placebo y además se trataba de pacientes que previamente habían demostrado beneficio con el tratamiento con adalimumab.
La pérdida de respuesta al adalimumab en la CU también ha sido evaluada por algunos investigadores en la práctica clínica. Ma et al. incluyeron 102 pacientes con CU que habían presentado respuesta al tratamiento con anti-TNFa, de los cuales 36 habían recibido adalimumab22. El objetivo principal del estudio fue comparar la tasa de pérdida de respuesta a los anti-TNFa, infliximab y adalimumab, en pacientes con CU que habían respondido inicialmente a estos fármacos. La elección del tipo de anti-TNFa infliximab o adalimumab fue a discreción del médico y del paciente. La duración media de seguimiento fue de 139 semanas para adalimumab y de 159 semanas para infliximab. La distribución de las principales variables fue similar en ambos grupos, a excepción de la puntuación media del índice de Mayo, que fue significativamente más elevada en los que recibieron infliximab. El porcentaje de pérdida de respuesta a lo largo del seguimiento fue similar en los pacientes tratados con infliximab y en los que recibieron adalimumab (59,1 frente a 58,5%, p=0,6). Los autores no identificaron factores de riesgo relacionados con la pérdida de respuesta22.
¿HAY ALGÚN FÁRMACO ANTI-TNFAQUE SEA MEJOR QUE OTRO PARAEL TRATAMIENTO DE LA CU?
En la actualidad existen 3 fármacos anti-TNFa aprobados para el tratamiento de la CU moderada-grave: infliximab por vía intravenosa, y adalimumab y golimumab por vía subcutánea. En el caso de la CU grave corticorrefractaria, únicamente ha sido evaluada la eficacia del infliximab. Sin embargo, para el resto situaciones clínicas podríamos plantearnos cuál sería el anti-TNFa de elección y si hay uno que sea más eficaz que los demás. Stidham et al. realizaron un metaanálisis en red con el objetivo de comparar la eficacia de infiximab, adalimumab y golimumab en la CU23. Para la realización de este tipo de metaanálisis se emplean los resultados de comparaciones directas entre un anti-
TNFa y un comparador común (en este caso placebo) para simular las comparaciones entre los distintos fármacos, permitiendo hacer una estimación de la eficacia. Pues bien, los autores confirmaron que los 3 fármacos son más eficaces que el placebo en la inducción y el mantenimiento de la remisión en la CU. Por otro lado, no observaron clara evidencia de superioridad de ninguno de los fármacos sobre los demás, aunque se observó una tendencia (no significativa estadísticamente) hacia mayores tasas de remisión y respuesta con infliximab que con adalimumab y golimumab23.
Por tanto, aunque es preciso tener en cuenta las limitaciones de este tipo de comparaciones indirectas, no parece haber diferencia de eficacia entre los 3 anti-TNFa en la CU y, por tanto, la elección del tratamiento debe basarse en otros factores como el coste, la vía de administración o las preferencias del paciente.
¿CONSIGUE EL ADALIMUMAB REDUCIREL NÚMERO DE HOSPITALIZACIONESEN PACIENTES CON CU?
Se ha estimado que aproximadamente un tercio de los pacientes con CU moderada-grave requiere al menos un ingreso hospitalario al año para el tratamiento de su enfermedad24. Los gastos derivados de los ingresos hospitalarios constituyen una proporción relevante de los costes totales del tratamiento de estos pacientes. Los costes directos asociados al tratamiento médico de la CU superan los 4 billones de dólares al año en Estados Unidos y los 5 billones de euros en Europa25. La administración de tratamientos que controlen la enfermedad y disminuyan la necesidad de ingresos hospitalarios contribuiría a disminuir los costes directos e indirectos asociados a la CU.
Recientemente, Feagan et al. evaluaron la influencia del tratamiento con adalimumab en la reducción de las hospitalizaciones en pacientes con CU24; para ello analizaron los datos de los estudios ULTRA 1 y ULTRA 2. Los autores observaron que la causa más frecuente de hospitalización fue el agravamiento del brote de CU y la causa más frecuente de hospitalización no relacionada con la CU fueron las infecciones. Durante la fase de inducción, el adalimumab redujo un 40% las hospitalizaciones por cualquier causa, y un 50% las hospitalizaciones relacionadas con la CU, en comparación con el grupo placebo. Al año de tratamiento, la tasa de incidencia de hospitalizaciones, tanto relacionadas como no relacionadas con la CU, fue significativamente más baja en los pacientes tratados con adalimumab que en los que recibieron placebo24.
¿ES EFICAZ EL ADALIMUMAB ENLA PREVENCIÓN DE LA COLECTOMÍAEN LOS PACIENTES CON CU?
El porcentaje de colectomía en los pacientes con CU ha descendido significativamente en los últimos años. Kaplan et al., en un reciente estudio, analizaron el periodo comprendido entre 1997 y 2009 y observaron una disminución de la tasa de colectomía de 5,4 a 2,3 por 100.000 pacientes-año, con un descenso anual de aproximadamente el 4% 26. Este descenso se debió sobre todo a un menor porcentaje de colectomías electivas, mientras que la tasa de incidencia de colectomía urgente se mantuvo estable en el período estudiado. Estos hallazgos son similares a los descritos por Moore et al.27 Así, los autores sugirieron que las colectomías urgentes podrían deberse a formas especialmente graves de CU que no podrían evitarse con el tratamiento médico con inmunosupresores ni biológicos. Posteriormente, Reich et al. evaluaron la tasa de colectomía comparando la evolución desde el inicio del uso de los fármacos anti-
TNFa con los resultados previos a su comercialización28. Los autores observaron un descenso significativo del porcentaje de colectomías a partir del año 2005, coincidiendo con un incremento en el uso de tratamientos anti-TNFa. No obstante, se trata de estudios epidemiológicos, en los que únicamente puede establecerse una relación temporal entre los distintos factores, sin que ello indique causalidad. De hecho, los autores reconocen que el tratamiento anti-TNFa podría no ser la única explicación para el descenso observado en la tasa de colectomías.
Los pacientes incluidos en los estudios ULTRA 1 y 2 tuvieron un riesgo bajo de colectomía8-9. Por un lado, aproximadamente el 20% de los pacientes incluidos en el ULTRA 1 no recibían ni corticoides ni inmunomoduladores. Además, en el estudio ULTRA 2 se excluyeron aquellos pacientes que no habían presentado al menos respuesta al infliximab previamente. En ambos estudios se excluyeron los casos con CU grave ingresados, por lo que los pacientes incluidos representan la subpoblación “menos grave” del global de pacientes con CU moderada a grave y refractarios a los tratamientos. Finalmente, los pacientes que no hubieran respondido en los estudios ULTRA 1 y ULTRA 2 podían ser incluidos en un estudio abierto de tratamiento con adalimumab; por tanto, es de suponer que los médicos responsables de los pacientes retrasarían la decisión de someter al paciente a colectomía hasta confirmar la falta de respuesta al adalimumab en el estudio abierto. Por todas estas razones, el porcentaje de colectomías en los estudios ULTRA fue muy bajo, menor del 5%, y el análisis sobre el impacto del adalimumab en la tasa de colectomía no pudo realizarse por insuficiente potencia estadística para demostrar diferencias entre los grupos de tratamiento (adalimumab y placebo)8-9.
Sin embargo, al contrario de lo que ocurría con las tasas de respuesta, las tasas de colectomía son más altas en los estudios observacionales que en los ensayos clínicos, tal y como se muestra en la Tabla II. Esto podría deberse a que muchos de los pacientes incluidos en los estudios de práctica clínica ya habían fracasado previamente al tratamiento con infliximab y presentaban una mayor refractariedad a los tratamientos convencionales.
¿ES SEGURO EL TRATAMIENTO CON ADALIMUMAB, PARTICULARMENTE EN LA CU?
En los ensayos clínicos, el perfil de seguridad del adalimumab fue similar al del placebo y la tasa de acontecimientos adversos comparable a la descrita en otros estudios que evalúan adalimumab para otras indicaciones8-9. Por ejemplo, en el estudio ULTRA 2, la incidencia de efectos adversos fue incluso mayor en los pacientes que recibieron placebo que en los tratados con adalimumab (846 eventos vs. 743 eventos/100 pacientes-año, respectivamente); no obstante, los pacientes que recibieron adalimumab refirieron con más frecuencia dolor en el lugar de punción y reacciones adversas hematológicas. Sin embargo, las tasas de acontecimientos adversos graves, infecciones y necesidad de interrupción del tratamiento fueron significativamente más altas en el grupo placebo que en el que recibió adalimumab.
En el estudio ULTRA 3, con un seguimiento de hasta 4 años, se analizaron los datos de más de 1.000 pacientes con CU que habían recibido al menos una dosis de adalimumab10. A pesar de contar con una exposición más prolongada al fármaco, la tasa de acontecimientos adversos fue globalmente más baja que la observada en los estudios de inducción, y la incidencia de infecciones y neoplasias fue similar. Únicamente reseñar por su interés que en este estudio hubo 3 casos de linfoma de células B, todos ellos en pacientes que estaban o habían estado en tratamiento con tiopurinas10. Por último, en los estudios observacionales, el porcentaje de acontecimientos adversos con el tratamiento con adalimumab fue el esperable y similar a lo observado con infliximab13-21.
¿ES ÚTIL EL TRATAMIENTO CON ADALIMUMAB EN LA RESERVORITIS REFRACTARIA?
Hasta el 60% de los pacientes con CU sometidos a colectomía total con reservorio ileoanal sufren reservoritis, y hasta el 25% de ellos presentan refractariedad al tratamiento médico convencional29. Barreiro-de Acosta et al presentaron una serie de 8 pacientes con proctitis refractaria al tratamiento convencional30; al año de tratamiento, se había evitado la ileostomía definitiva en la mitad de los pacientes, y de ellos 2 se encontraban en remisión. A pesar del número limitado de pacientes, los resultados de este estudio sugieren la posible utilidad del adalimumab en la reservoritis refractaria30.
¿PODRÍA SER ÚTIL LA MEDICIÓN DENIVELES DE ADALIMUMAB Y ANTICUERPOSCONTRA EL FÁRMACO PARA OPTIMIZAREL TRATAMIENTO EN LA CU?
La medición de los niveles de anti-TNF y de anticuerpos contra el fármaco se ha propuesto como una herramienta útil para optimizar el tratamiento en los pacientes con enfermedad inflamatoria intestinal31. Seow et al. describieron por primera vez la importancia de los niveles de infliximab en la evolución en los pacientes con CU corticorrefractaria32. En este estudio, el porcentaje de colectomía en los pacientes con niveles indetectables de infliximab fue significativamente más alto que en los pacientes con niveles detectables (55% vs. 7%). En este mismo sentido, recientemente se han publicado los resultados de un subanálisis de los estudios ACT 1 y 2 en el que los autores observaron una concentración media de infliximab significativamente más alta en las semanas 8, 30 y 54 en los pacientes con remisión, respuesta clínica o cicatrización mucosa que en aquellos que no alcanzaron estos objetivos33. No obstante, se observó una gran heterogeneidad en las concentraciones de los distintos pacientes. Los autores concluyeron que la presencia de niveles de infliximab por encima de 40 μg/mL en la semana 8 y por encima de 3,7 μg/mL a lo largo del seguimiento eran factores predictores de buena evolución33.
Estos resultados han planteado la cuestión de si, en el caso de la CU, sería más eficaz la administración de una mayor dosis de inducción para conseguir la remisión en los pacientes con CU. Gibson et al. compararon la evolución de pacientes con CU corticorrefractaria tratados en un mismo centro desde 2005 hasta 201334. Hasta 2011, los pacientes recibieron tratamiento con infliximab 5 mg/kg en las semanas 0, 2 y 6 y, posteriormente, 5 mg/kg cada 8 semanas. A partir de esa fecha, todos los pacientes recibieron una pauta de inducción acelerada consistente en la administración de 3 dosis de infliximab 5 mg/kg en los primeros 24 días y, posteriormente, 5 mg/kg cada 8 semanas. Los autores observaron que el porcentaje de colectomías fue significativamente más bajo en los pacientes que recibieron la pauta acelerada que en aquellos tratados con la dosis estándar (6,7% vs. 40%, p=0,03).
La experiencia publicada con adalimumab es más escasa que con infliximab. En el estudio ULTRA 2, la concentración sérica media de adalimumab fue significativamente más alta en los pacientes en remisión en las semanas 8 y 52 que en aquéllos con actividad9. El 2,9% de los pacientes (7 de 245) desarrollaron anticuerpos contra adalimumab; todos ellos recibían este tratamiento en monoterapia. Estos hallazgos sugieren que también el tratamiento con adalimumab en la CU podría optimizarse mediante la administración concomitante de inmunosupresores e individualizarse en función de las concentraciones séricas del fármaco. No obstante, este no fue el objetivo principal del estudio y por ello los resultados deben interpretarse con cautela.
Por otro lado, Suzuki et al. evaluaron los niveles del fármaco en función de la remisión11. No se observaron diferencias en cuanto a la concentración de adalimumab en función de que los pacientes hubieran o no alcanzado la remisión en la semana 8. En la semana 52, los pacientes que se encontraban en remisión presentaban concentraciones más altas de adalimumab que aquéllos que no habían alcanzado la remisión. No obstante, debido a la gran heterogeneidad en las concentraciones de los distintos pacientes, se observó un amplio solapamiento entre los pacientes que alcanzaron la remisión y los que no11.
Recientemente, Roblin et al. evaluaron la correlación entre los niveles séricos de adalimumab y la presencia de cicatrización mucosa35. Incluyeron a 40 pacientes (18 con CU) y observaron que los niveles valle de adalimumab eran significativamente más altos en los pacientes con cicatrización mucosa. Así, la presencia de concentraciones de adalimumab superiores a 4,9 μg/mL fue predictor de remisión clínica y de cicatrización mucosa.
¿ES COSTE-EFICAZ EL TRATAMIENTOCON ADALIMUMAB EN LA CU?
Los biológicos son actualmente los principales responsables de los costes directos del tratamiento de los pacientes con enfermedad inflamatoria intestinal y, por tanto, el balance coste-efectividad de cada fármaco debe ser tenido en consideración. A pesar de que su coste es elevado, los anti-TNFa están indicados en pacientes refractarios a los tratamientos convencionales, pudiendo evitar eventuales hospitalizaciones por reactivación de la enfermedad. Es preciso tener en cuenta que los resultados de los estudios de coste-efectividad varían dependiendo de cada país y de cada sistema de salud. Además de la eficacia del tratamiento, existen otros muchos factores que influyen en este balance: los costes del tratamiento en cada país, los costes de las terapias alternativas, el punto de corte preestablecido para definir qué se considera “coste-eficaz”, etc.
Tsai et al. realizaron un análisis de coste-efectividad de los tratamientos anti-TNF en la CU basado en la estimación de costes del National Health Service of England and Wales en el año 2007 36. Considerando la respuesta como objetivo primario, el tratamiento con infliximab supone 0,753 años de vida ajustados por calidad (AVAC), con un incremento de coste por AVAC de 27.427 libras del infliximab en comparación con el tratamiento estándar. Considerando únicamente remisión, el tratamiento con infliximab supuso un incremento de 0,87 AVAC, con un aumento del coste de 19.696 libras en comparación con el tratamiento estándar. Los autores concluyeron que el tratamiento con infliximab es una opción coste-efectiva en los pacientes con CU moderada-grave36.
Sin embargo, en un reciente estudio realizado por Park et al., los autores se basaron en un modelo teórico de Markov con dos cohortes de pacientes de 21 años con CU grave en seguimiento hasta los 100 años o hasta el fallecimiento37. Se comparó la relación coste-efectividad de la proctocolectomía total con reservorio ileoanal con el tratamiento médico (incluyendo el infliximab). En este estudio, los autores estimaron que el coste del tratamiento médico de la CU grave a lo largo de la vida es del 236.370 dólares por paciente, mientras que el coste del tratamiento quirúrgico precoz es de 147.763 dólares por paciente. El incremento de AVAC con el tratamiento médico fue de 20,78 y el de la cirugía precoz de 20,72, con una proporción incremental de coste-efectividad de 1,5 millones por AVAC ganados. Por lo tanto, los autores concluyeron que la proctocolectomía total con reservorio ileoanal tras el diagnóstico de una CU grave reduce los costes asociados a la CU, proporcionando, al mismo tiempo, una calidad de vida comparable al tratamiento médico estándar. Sólo en los casos en los que el paciente mantenga una calidad de vida extremadamente mala tras la cirugía, el tratamiento médico habría sido el óptimo en el caso de la CU grave37.
Finalmente, la mayoría de los estudios de coste-efectividad están publicados únicamente en forma de resumen y, por cuestiones de espacio, no presentan información detallada sobre la metodología, las definiciones de efectividad o los objetivos clínicos o las estrategias en el caso de pérdida de eficacia. Únicamente la publicación completa de los estudios en revistas de alto impacto permitirá la comparación de los resultados y el análisis de cada escenario. Debido a la reciente aprobación de adalimumab y golimumab para la CU, no disponemos de estudios publicados que hayan evaluado específicamente su coste-efectividad en el tratamiento de la CU.
CONCLUSIONES
El adalimumab ha demostrado ser eficaz en la inducción y el mantenimiento de la remisión en los pacientes con CU moderada-grave, siendo la magnitud de su efecto probablemente mayor en la práctica clínica que en los ensayos clínicos. Debido a que ninguno de los anti-TNFa parece ser más eficaz que los demás en el tratamiento de la CU, la elección de uno u otro debe basarse en otros factores como la vía de administración o la preferencia del paciente. Sin embargo, el adalimumab, al igual que el golimumab, no ha sido evaluado en el caso de la CU grave corticorrefractaria, por lo que se desconoce su papel en esta situación clínica. Por otro lado, el tratamiento con adalimumab es seguro. pudiendo ser tolerado incluso en pacientes que han presentado acontecimientos adversos con el infliximab. La medición de los niveles de adalimumab podría ayudar a optimizar el tratamiento. No obstante, los datos sobre su utilidad en la CU son aún muy limitados. La relación coste-eficacia del tratamiento de la CU con anti-TNFa, incluido el adalimumab, es controvertida.
BIBLIOGRAFÍA
1. Dignass A, Eliakim R, Magro F, Maaser C, Chowers Y, Geboes K, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 1: definitions and diagnosis. J Crohns Colitis 2012 Dec;6(10):965-90.
2. Sokol H, Seksik P, Cosnes J. Complications and surgery in the inflammatory bowel diseases biological era. Curr Opin Gastroenterol 2014 Jul;30(4):378-84.
3. Van Deventer SJ. Tumour necrosis factor and Crohn’s disease. Gut 1997 Apr;40(4):443-8.
4. Murch SH, Lamkin VA, Savage MO, Walker-Smith JA, MacDonald TT. Serum concentrations of tumour necrosis factor alpha in childhood chronic inflammatory bowel disease. Gut 1991 Aug;32(8):913-7.
5. Murch SH, Braegger CP, Walker-Smith JA, MacDonald TT. Location of tumour necrosis factor alpha by immunohistochemistry in chronic inflammatory bowel disease. Gut 1993 Dec;34(12):1705-9.
6. Braegger CP, Nicholls S, Murch SH, Stephens S, MacDonald TT. Tumour necrosis factor alpha in stool as a marker of intestinal inflammation. Lancet 1992 Jan 11;339(8785):89-91.
7. Rutgeerts P, Sandborn WJ, Feagan BG, Reinisch W, Olson A, Johanns J, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005 Dec 8;353(23):2462-76.
8. Reinisch W, Sandborn WJ, Hommes DW, D’Haens G, Hanauer S, Schreiber S, et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut 2011 Jun;60(6):780-7.
9. Sandborn WJ, van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012 Feb;142(2):257-65 e1-3.
10. Colombel JF, Sandborn WJ, Ghosh S, Wolf DC, Panaccione R, Feagan B, et al. Four-year maintenance treatment with adalimumab in patients with moderately to severely active ulcerative colitis: Data from ULTRA 1, 2, and 3. Am J Gastroenterol 2014 Nov;109(11):1771-80.
11. Suzuki Y, Motoya S, Hanai H, Matsumoto T, Hibi T, Robinson AM, et al. Efficacy and safety of adalimumab in Japanese patients with moderately to severely active ulcerative colitis. J Gastroenterol 2014 Feb;49(2):283-94.
12. Hanauer SB, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, MacIntosh D, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. Gastroenterology 2006 Feb;130(2):323-33; quiz 591.
13. Oussalah A, Laclotte C, Chevaux JB, Bensenane M, Babouri A, Serre AA, et al. Long-term outcome of adalimumab therapy for ulcerative colitis with intolerance or lost response to infliximab: a single-centre experience. Aliment Pharmacol Ther 2008 Oct 15;28(8):966-72.
14. Afif W, Leighton JA, Hanauer SB, Loftus EV, Jr., Faubion WA, Pardi DS, et al. Open-label study of adalimumab in patients with ulcerative colitis including those with prior loss of response or intolerance to infliximab. Inflamm Bowel Dis 2009 Sep;15(9):1302-7.
15. Hudis N, Rajca B, Polyak S, Zeilman C, Velentine J. The outcome of active ulcerative colitis treated with adalimumab. Gastroenterology 2009;136(5 Suppl 1):A661.
16. Gies N, Kroeker KI, Wong K, Fedorak RN. Treatment of ulcerative colitis with adalimumab or infliximab: long-term follow-up of a single-centre cohort. Aliment Pharmacol Ther 2010 Aug;32(4):522-8.
17. Taxonera C, Estelles J, Fernández-Blanco I, Merino O, Marín-Jiménez I, Barreiro-de Acosta M, et al. Adalimumab induction and maintenance therapy for patients with ulcerative colitis previously treated with infliximab. Aliment Pharmacol Ther 2011 Feb;33(3):340-8.
18. Ferrante M, Karmiris K, Compernolle G. Efficacy of adalimumab in patients with ulcerative colitis:restoration of serum levels after dose escalation results in a better long-term outcome. Gut 2011;60(Suppl 3):A72.
19. McDermott E, Murphy S, Keegan D, O’Donoghue D, Mulcahy H, Doherty G. Efficacy of Adalimumab as a long term maintenance therapy in ulcerative colitis. J Crohns Colitis 2013 Mar;7(2):150-3.
20. García-Bosch O, Gisbert JP, Canas-Ventura A, Merino O, Cabriada JL, García-Sánchez V, et al. Observational study on the efficacy of adalimumab for the treatment of ulcerative colitis and predictors of outcome. J Crohns Colitis 2013 Oct 1;7(9):717-22.
21. Armuzzi A, Biancone L, Daperno M, Coli A, Pugliese D, Annese V, et al. Adalimumab in active ulcerative colitis: a “real-life” observational study. Dig Liver Dis 2013 Sep;45(9):738-43.
22. Ma C, Huang V, Fedorak DK, Kroeker KI, Dieleman LA, Halloran BP, et al. Outpatient Ulcerative Colitis Primary Anti-TNF Responders Receiving Adalimumab or Infliximab Maintenance Therapy Have Similar Rates of Secondary Loss of Response. J Clin Gastroenterol 2014 Nov 11.
23. Stidham RW, Lee TC, Higgins PD, Deshpande AR, Sussman DA, Singal AG, et al. Systematic review with network meta-analysis: the efficacy of anti-TNF agents for the treatment of Crohn’s disease. Aliment Pharmacol Ther 2014 Jun;39(12):1349-62.
24. Feagan BG, Sandborn WJ, Lazar A, Thakkar RB, Huang B, Reilly N, et al. Adalimumab therapy is associated with reduced risk of hospitalization in patients with ulcerative colitis. Gastroenterology 2014 Jan;146(1):110-8 e3.
25. Cohen RD, Yu AP, Wu EQ, Xie J, Mulani PM, Chao J. Systematic review: the costs of ulcerative colitis in Western countries. Aliment Pharmacol Ther 2010 Apr;31(7):693-707.
26. Kaplan GG, Seow CH, Ghosh S, Molodecky N, Rezaie A, Moran GW, et al. Decreasing colectomy rates for ulcerative colitis: a population-based time trend study. Am J Gastroenterol 2012 Dec;107(12):1879-87.
27. Moore SE, McGrail KM, Peterson S, Raval MJ, Karimuddin AA, Phang PT, et al. Infliximab in ulcerative colitis: the impact of preoperative treatment on rates of colectomy and prescribing practices in the province of British Columbia, Canada. Dis Colon Rectum 2014 Jan;57(1):83-90.
28. Reich KM, Chang HJ, Rezaie A, Wang H, Goodman KJ, Kaplan GG, et al. The incidence rate of colectomy for medically refractory ulcerative colitis has declined in parallel with increasing anti-TNF use: a time-trend study. Aliment Pharmacol Ther 2014 Sep;40(6):629-38.
29. Johnson MW, Das P, Dewar DH, Forbes A, Ciclitira PJ, Nicholls RJ. Medical management of patients with ileal pouch anal anastomosis after restorative procto-colectomy. Eur J Gastroenterol Hepatol 2009 Jan;21(1):9-17.
30. Barreiro-de Acosta M, Garcia-Bosch O, Gordillo J, Manosa M, Menchen L, Souto R, et al. Efficacy of adalimumab rescue therapy in patients with chronic refractory pouchitis previously treated with infliximab: a case series. Eur J Gastroenterol Hepatol 2012 Jul;24(7):756-8.
31. Chaparro M, Guerra I, Munoz-Linares P, Gisbert JP. Systematic review: antibodies and anti-TNF-alpha levels in inflammatory bowel disease. Aliment Pharmacol Ther 2012 Mar 22.
32. Seow CH, Newman A, Irwin SP, Steinhart AH, Silverberg MS, Greenberg GR. Trough serum infliximab: a predictive factor of clinical outcome for infliximab treatment in acute ulcerative colitis. Gut 2010 Jan;59(1):49-54.
33. Adedokun OJ, Sandborn WJ, Feagan BG, Rutgeerts P, Xu Z, Marano CW, et al. Association between serum concentration of infliximab and efficacy in adult patients with ulcerative colitis. Gastroenterology 2014 Dec;147(6):1296-307 e5.
34. Gibson DJ, Heetun ZS, Redmond CE, Nanda KS, Keegan D, Byrne K, et al. An Accelerated Infliximab Induction Regimen Reduces the Need for Early Colectomy in Patients With Acute Severe Ulcerative Colitis. Clin Gastroenterol Hepatol 2014 Jul 30.
35. Roblin X, Marotte H, Rinaudo M, Del Tedesco E, Moreau A, Phelip JM, et al. Association between pharmacokinetics of adalimumab and mucosal healing in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2014 Jan;12(1):80-4 e2.
36. Tsai HH, Punekar YS, Morris J, Fortun P. A model of the long-term cost effectiveness of scheduled maintenance treatment with infliximab for moderate-to-severe ulcerative colitis. Aliment Pharmacol Ther 2008 Nov 15;28(10):1230-9.
37. Park KT, Tsai R, Perez F, Cipriano LE, Bass D, Garber AM. Cost-effectiveness of early colectomy with ileal pouch-anal anastamosis versus standard medical therapy in severe ulcerative colitis. Ann Surg 2012 Jul;256(1):117-24.
