Adalimumab en la enfermedad de Crohn; ¿Es obligado o prescindible el tratamiento combinado con inmunosupresores?
Jesús Barrio Andrés
Servicio de Digestivo. Hospital Universitario Río Hortega. Valladolid.
RESUMEN
La enfermedad de Crohn es un trastorno inflamatorio crónico, con episodios recurrentes agudos que ocasionan un daño acumulativo y progresivo a nivel intestinal. En los últimos años se da cada vez más importancia al concepto, importado de la Reumatología, de la “ventana terapéutica” definido como el momento oportuno para utilizar el tratamiento más eficiente. Los fármacos biológicos contra el factor de necrosis tumoral alfa (antiTNF) han revolucionado el tratamiento de la EII en la última década. El debate sobre si el antiTNF debe usarse solo o en combinación con inmunosupresores (INM) continúa sin resolverse. La eficacia de adalimumab (ADA) en monoterapia, comparada con el tratamiento combinado con INM, nunca ha sido evaluada en un estudio controlado. Revisaremos la evidencia actual que nos puede ayudar a elegir la mejor opción (monoterapia versus tratamiento combinado) en la enfermedad de Crohn.
INTRODUCCIÓN
La enfermedad de Crohn (EC) es un trastorno inflamatorio crónico con episodios recurrentes agudos que ocasionan un daño acumulativo y progresivo a nivel intestinal(1). El tratamiento clásico (“step-up”), adaptado en función de la actividad clínica, no parece ser capaz de cambiar la historia natural de la enfermedad (2). En los últimos años se da cada vez más importancia al concepto, importado de la Reumatología, de la “ventana terapéutica” definido como el momento oportuno para utilizar el tratamiento más eficiente (3).
En la última década, los fármacos contra el factor de necrosis tumoral alfa (antiTNF) han revolucionado el tratamiento de la EC; sin embargo, continúa presentando diferentes interrogantes sobre la estrategia más eficaz. Desde la introducción de los antiTNF en el arsenal terapéutico de la EC, es probable que una de las cuestiones más controvertidas y que más variaciones está sufriendo, es la necesidad de asociar o no el tratamiento concomitante con inmunosupresores (INM).(4) Además, en los próximos años surgirán nuevos datos que podrían hacernos cambiar nuevamente el planteamiento actual, donde la elección, como veremos, no presenta una evidencia tan robusta como en los ensayos controlados en pacientes con artritis reumatoide donde la terapia combinada ha demostrado una eficacia claramente superior. (5)
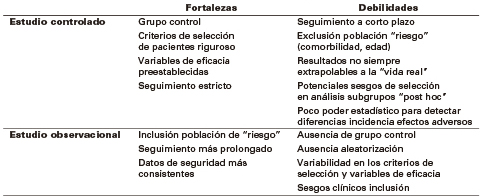
Características de los estudios controlados y observacionales

TABLA I
Las recomendaciones del Grupo de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) sobre el uso de fármacos antiTNF en la EII en 2013 son tajantes a la hora de recomendar de forma sistemática el tratamiento concomitante con INM (tiopurinas, cuando sea posible) en todos los casos de inicio de tratamiento con antiTNF. Esta recomendación es independiente de si el paciente había presentado fracaso previo a INM o no con el fin de aumentar la eficacia clínica y prolongar su rendimiento a largo plazo.(6) No obstante, la evidencia que sustenta esta afirmación está basada casi exclusivamente en estudios con infliximab (IFX). Por otra parte, en el segundo consenso de ECCO sobre el tratamiento actual de la EC, ésta es una cuestión sobre la que no se establece una recomendación definida. (7)
El adalimumab (ADA) es un anticuerpo monoclonal recombinante completamente humano de clase IgG1que bloquea selectivamente el TNF alfa humano, tanto el soluble como el unido a membrana, posibilitando la apoptosis de los linfocitos y monocitos activados, además de disminuir la producción de citoquinas pro-inflamatorias. (8)
Para la elección de la modalidad de tratamiento (monoterapia vs combinado) es importante conocer y valorar las conclusiones finales de los estudios (Tabla I) en función de las características de sus diseños (9). En la planificación terapéutica deberíamos analizar de forma conjunta la gravedad de la enfermedad, los riesgos/beneficios del tratamiento y las preferencias de los pacientes.
En la presente artículo revisaremos la eficacia de las dos pautas de tratamiento con ADA (con y sin INM), la influencia en la inmunogenicidad de los INM y los riesgos asociados al tratamiento combinado, fundamentalmente infecciones y tumores.
EFICACIA CLÍNICA EN ENSAYOS CONTROLADOS Y OBSERVACIONALES
Según la estrategia de tratamiento con ADA, se pueden diferenciar dos situaciones clínicas escenarios terapeúticos. Por un lado, el tratamiento clásico (“step-up”) donde la asociación de ADA se añade al tratamiento previo con INM y, por otro lado, la situación donde los pacientes son “naive” para ambos fármacos; INM y biológico (“top-down”).
A diferencia del infliximab (IFX) donde el tratamiento combinado con AZA ha demostrado ser más efectivo (respuesta clínica, remisión y curación mucosa) que la monoterapia en pacientes sin tratamiento previo con INM, (10) no existen estudios controlados con ADA en esta población de pacientes con EC.
Podemos extraer datos de eficacia a partir del subanálisis de los pacientes incluidos en los estudios pivotales de ADA frente a placebo.(11-15) Tanto para la inducción como para el mantenimiento, la estratificación según el uso concomitante de INM no muestra diferencias en términos de remisión clínica ni curación mucosa (Tabla II). Además, el impacto del tratamiento combinado ADA-INM ha sido analizado con resultados contradictorios en diferentes estudios observacionales. Reenaers C et al. (16) en un estudio retrospectivo donde se recoge la experiencia de dos centros de referencia, demuestran una ausencia de impacto del tratamiento combinado en el riesgo de nuevos brotes o de fracaso del tratamiento con ADA. Sin embargo, la terapia combinada durante el primer semestre del inicio del tratamiento con ADA se asoció a un menor riesgo de fracaso (5% vs 10%) y la combinación durante más de 6 meses se asoció con un menor número de semestres en brote (14% vs 36%). Igualmente, Lofberg et al. (17) en el estudio abierto CARE, encuentran con el tratamiento combinado un aumento de la probabilidad de alcanzar la remisión clínica después de la inducción en la semana 4 (46% vs 39%) y durante el seguimiento a corto plazo en la semana 20 (55% vs 49%, p NS). Una serie abierta holandesa, ha puesto de manifiesto la utilidad del cotratamiento con INM en los primeros 6 meses para el mantenimiento de la respuesta a largo plazo. (18) Así mismo, en otra serie abierta belga, Baert et al. (19) encuentran una mayor necesidad de intensificación con ADA en los casos sin tratamiento INM al inicio del biológico o con una duración del cotratamiento menor de 3 meses. Por el contrario, otros estudios observacionales no han encontrado diferencias entre la monoterapia y el tratamiento combinado en el mantenimiento de la respuesta, (20) en la necesidad de intensificación del tratamiento biológico (21) o en el porcentaje de remisión libre de esteroides a los 3 años. (22) Tampoco se ha demostrado influencia en la respuesta cuando el ADA era utilizado como segundo (23) o tercer biológico. (24)
Remisión clínica (CDAI) y curación mucosa en subanálisis según tratamiento combinado con inmunosupresores o monoterapia con adalimumab

TABLA II
Una revisión sistemática reciente (25) con inclusión de los estudios controlados junto a estudios abiertos prospectivos y de cohortes retrospectivas de pacientes con EC tratados con ADA, demuestra que aunque la monoterapia con ADA fue ligeramente inferior al tratamiento combinado en la inducción de la remisión (semana 12) (OR 0.78; IC 95% 0.64-0.96), el tratamiento combinado no tiene ningún impacto a largo plazo (1 año) en el mantenimiento de la remisión (OR 1.08; IC 95% 0.79-1.4) ni en la necesidad de escalada de dosis (OR 1.13; IC 95% 0.69-1.85). Sin embargo, estos resultados deben interpretarse con precaución pues únicamente el estudio retrospectivo antes comentado de Reenaers C et al. (16) estaba dirigido a la comparación de ambas estrategias de tratamiento y diversos factores de confusión no controlados pueden influir en las conclusiones (fenotipo, cirugía previa, uso previo de otro antiTNF, momento inicio y duración tratamiento INM, hábito tabáquico, etc.).
Los datos sobre eficacia para los 3 antiTNF (IFX,ADA y certolizumab CTZ) en la enfermedad de Crohn, han sido revisados en otro meta-análisis reciente (26) que incluye 11 estudios controlados donde no se demuestra un beneficio clínico del tratamiento combinado en la remisión a los 6 meses (OR 1.06; IC 95% 0.83-1.35), en la inducción o mantenimiento de la respuesta (OR 1.06; IC 95% 0.81-1.40 y OR 1.46; IC 95% 0.70-3.05) o para el cierre parcial o completo de fístulas (OR 1.26; IC 95% 0.84-1.88 y OR 1.1; IC 95% 0.68-1-79). El subanálisis por biológico muestra mayor eficacia del tratamiento combinado frente a la monoterapia para IFX pero sin beneficio clínico para ADA y CTZ (Figura 1). Una posible explicación para la diferencia de resultados del tratamiento combinado entre IFX y ADA podría ser el efecto demostrado del IFX en los niveles de los metabolitos de las tiopurinas (27) (elevación de los niveles de 6-tioguanina) que no se ha demostrado con la asociación de ADA. (28) Recientemente ha sido comunicado un efecto positivo de la asociación de tiopurinas al ADA en lo que respecta a la respuesta primaria y menor pérdida de respuesta, únicamente en los pacientes con niveles de tioguanina en rango terapeútico. (29) No obstante, variaciones relacionadas con los diseños de los estudios, así como en las poblaciones incluidas, limitan las conclusiones de este meta-análisis.
Finalmente, en caso de pérdida de respuesta a ADA en monoterapia, la adicción de tiopurinas podría recuperar la respuesta. (30)
Figura 1.- Meta-análisis de 11 estudios controlados en la enfermedad de Crohn luminal y/o fi stulizante que reciben antiTNF con/sin IMM (Modifi cada de Jones et al. 26) Remisión clínica a los 6 meses y uso concomitante de inmunosupresores.
INMUNOGENICIDAD
La producción de anticuerpos frente a las terapias biológicas es uno de los aspectos más importantes relacionados con la pérdida de eficacia y aparición de efectos secundarios en la EII. La mayor información sobre este fenómeno se basa nuevamente en estudios con IFX donde el tratamiento concomitante con INM se asocia a una reducción en la formación de anticuerpos frente a IFX, mayores niveles séricos de fármaco, disminución del aclaramiento del biológico y mejor resultado clínico.(31) Series iniciales muestran porcentajes de formación de anticuerpos anti-adalimumab (AAA) menores que con IFX, (9’2%); (32) sin embargo, en los estudios más recientes con técnicas de determinación más sensibles, se detectan porcentajes más altos (44%). (33) La relevancia clínica real de los anticuerpos antiTNF está todavía por establecer y son los niveles valle del fármaco el factor que más se ha asociado al mantenimiento de la respuesta clínica a los antiTNF en la EII. (6)
En los estudios pivotales CLASSIC I y II, los niveles valle de ADA tienden a ser significativamente mayores en los casos en remisión sin embargo, las concentraciones muestran un gran solapamiento entre los pacientes con remisión y aquellos sin ella. El uso concomitante de INM al inicio se asocia a niveles valle de ADA más elevados pero nuevamente con gran solapamiento en los intervalos (Tabla III). (34)
En el estudio CLASSIC II (12) se determinó la presencia de AAA en 269 pacientes siendo positivos únicamente en 7 casos (2,6%), no detectándose en ninguno de los pacientes bajo tratamiento combinado con INM. Por este motivo, lo que podemos concluir que el tratamiento combinado demostró un beneficio, no estadísticamente significativo, en la prevención de AAA (3’8% monoterapia vs 0% tratamiento combinado). El papel que juegan los AAA en la eficacia clínica no queda tan claro al analizar la evolución clínica de estos 7 pacientes con AAA del CLASSIC II, ya que 3 de ellos (43%) estaban en remisión en la semana 24 y 2 (29%) permanecían en remisión al final del seguimiento (semana 56).
Concentraciones séricas de ADA (microg/ml) y uso de inmunosupresores en CLASSIC I y II (modificada de Chiu et al 34)

TABLA III
En la serie retrospectiva belga previamente comentada, (32) la suspensión del tratamiento con ADA como segundo biológico, se relacionaba con niveles séricos más bajos; circunstancia más frecuente en los casos con presencia de AAA, sin embargo, no encontraron ningún impacto del uso concomitante de INM en la formación de AAA. Resultados similares se observan en el estudio retrospectivo holandés de Van Schaik et al. (35) donde en el seguimiento a más de 2 años de 109 pacientes con EII tratados con ADA, no se observó ningún efecto de la utilización concomitante de INM en la formación de AAA a diferencia de los casos tratados con IFX durante el mismo periodo de tiempo, donde el cotratamiento se asoció con concentraciones más elevadas y menor formación de anticuerpos contra IFX.
Mazor et al. (36) en un estudio transversal encuentra que los niveles séricos altos de ADA se asocian con remisión con un punto de corte óptimo de 5,85 µg/ml y, niveles altos de AAA, se asociaban con actividad de la enfermedad. No obstante, el diseño transversal impide sacar conclusiones de causalidad. Nuevamente la asociación de INM tampoco no influyó ni en los niveles séricos ni en los AAA.
Con los datos publicados hasta la fecha respecto a la farmacocinética del ADA en la EC, podemos concluir que el tratamiento combinado se asocia con concentraciones valle ligeramente superiores pero circunstancia que no parece tener repercusión en la tasa de remisión a corto o medio plazo. No obstante, la falta de datos concluyentes no debe ser mal interpretada en el sentido de que el tratamiento con INM no proteja contra frente a la formación de AAA; (9) serían necesarios ensayos controlados que aborden este problema para sacar conclusiones. Estos resultados contrastan con la experiencia de los reumatólogos en artritis reumatoide, donde el tratamiento combinado ADA+MTX ha demostrado una menor formación de AAA y un claro beneficio clínico. (37,38)
RIESGOS DEL TRATAMIENTO / EFECTOS ADVERSOS
Las diferencias en el perfil de seguridad constituyen el aspecto más difícilmente evaluable entre ambas estrategias de tratamiento debido a las limitaciones intrínsecas de los ensayos clínicos controlados y los estudios observacionales o registros prospectivos para analizar esta cuestión (Tabla I). Al valorar los riesgos del tratamiento, debemos prestar atención al riesgo de infecciones y de neoplasias; fundamentalmente el linfoma y el cáncer de piel Here Pyramid The document distinto del melanoma (CPNM).
Figura 2.- Datos sobre seguridad en los estudios de desarrollo de adalimumab en enfermedad Crohn (GAIN, CLASSIC I y II, CHARM, ADHERE) (modificada de Sandborn et al 41)

Figura 3.- Estudio PYRAMID. Análisis a 5 años (modificada de D´Haens et al 42)

Infecciones
El uso de fármacos antiTNF se asocia a un riesgo de enfermedades infecciosas mayor al observado en las poblaciones control. (6) Las revisiones más completas confirman un aumento del riesgo relativo de infecciones con una OR de 1.19 (IC 95%: 1.09-1.30). (39) La edad (> 65 años) es un factor de riesgo independiente para infecciones graves y mortalidad en relación con el tratamiento antiTNF. (40)
El tratamiento combinado aumenta el riesgo de infecciones graves y oportunistas por encima del observado en monoterapia con antiTNF, aunque con unas tasas similares al uso de INM en monoterapia en los estudios observacionales. (9) No obstante, el mayor riesgo deriva de la asociación de corticoides a cualquiera de los otros dos fármacos. (9)
Con respecto al tratamiento con ADA, similares conclusiones se desprenden del análisis agrupado de las infecciones graves en los estudios GAIN, CLASSIC I y II, CHARM y ADHERE. (41) (Figura 2) y en el registro observacional, prospectivo, no intervencionista, PYRAMID (42) (Figura 3).
El uso de fármacos antiTNF es razonablemente seguro y puede serlo más con el empleo de las medidas preventivas adecuadas. (6, 43)
Neoplasias
Un metaánalisis de los estudios controlados con antiTNF en EII ha puesto de manifiesto la ausencia de un mayor riesgo de neoplasia, aunque el seguimiento de los estudios incluidos fue corto (56 semanas máximo). (44) Un reciente estudio de cohortes (45) danés, que incluye a 56.146 pacientes con una mediana de seguimiento de 3,7 años, tampoco encuentra un mayor riesgo de cáncer entre los expuestos a antiTNF; de forma global ni tampoco en función de la duración de la exposición fármaco o de las dosis acumuladas.
En relación con ADA, Osterman et al. (46) en un análisis conjunto de los datos de los ensayos clínicos CLASSIC I y II, GAIN, CHARM, EXTEND y ADHERE, con una mediana de seguimiento de 1,5 años, compara las tasas de tumores entre los pacientes que recibieron tratamiento combinado y monoterapia con ADA, con las tasas esperadas en la población general (misma edad y sexo).
El empleo actual o pasado de tiopurinas aumenta el riesgo de CPNM (47) al incorporarse al ADN de la piel y generar metabolitos mutagénicos en presencia de radiación ultravioleta A. De acuerdo con esto los pacientes que reciben ADA e INM tuvieron un mayor riesgo de desarrollar CPNM en comparación con la monoterapia con ADA y con la población general (razón de incidencia estandarizada (SIR) 3,46 (IC 95%: 1,8-11,6) y SIR 4,59 (IC 95%: 2,51-7,70) respectivamente). No obstante, también se ha demostrado un riesgo mayor de CPNM en pacientes bajo tratamiento con antiTNF. (48) Además, tenemos que tener en cuenta que la propia EII supone un riesgo aumentado para este tipo de tumores (49) por lo que las recomendaciones preventivas deberían extenderse a todos los casos de EII independientemente del tipo de tratamiento prescrito. Por este motivo, podríamos concluir que el mayor riesgo de CPNM no debería influir en la elección del tratamiento con tiopurinas, siendo más importante las medidas preventivas y los controles dermatológicos regulares.
En el estudio de Osterman et al.(46) los pacientes que recibieron tratamiento combinado también tenían mayor riesgo de sufrir neoplasias distintas al CPNM en comparación con los pacientes en monoterapia con ADA y con la población general (SIR 2,82 (IC 95%: 1,07- 7,44) y SIR 3,04 (IC 95%: 1,66-5,10) respectivamente). Estos resultados deben interpretarse con precaución si se piensa en la posibilidad de resultados diferentes en seguimiento a más largo plazo y así como tampoco se puede determinar el papel que podría jugar el tratamiento previo con INM en el grupo de monoterapia con ADA. Además, por otro lado, el análisis conjunto de todos los tumores sólidos no permite determinar el riesgo de cada tipo de tumor individualmente y su relación con la inmunosupresión.
El tratamiento con tiopurinas aumenta 5 veces el riesgo de desarrollar un proceso linfoproliferativo respecto a la población general, siendo factores de riesgo, la edad > 65 años, el sexo masculino y el tratamiento activo (no pasado) con tiopurinas. Sin embargo, el riesgo absoluto acumulado en pacientes jóvenes (< 50 años) que reciben tratamiento con tiopurinas durante más de 10 años es bajo (< 1 %). (50, 51) El linfoma hepato-esplénico es una forma infrecuente y muy agresiva de linfoma descrita en pacientes varones jóvenes (< 35 años) con EII y tratados con tiopurinas (al menos durante 2 años) tanto en monoterapia como combinadas con antiTNF. (52) Aunque su incidencia es extremadamente baja, debe tenerse en cuenta y valorar la posibilidad de realizar monoterapia en este subgrupo de pacientes.
Por lo tanto, sabemos que las tiopurinas incrementan el riesgo de linfoma y de CPNM pero no disponemos de estudios con suficiente poder estadístico para comparar cuál es el riego de neoplasia en pacientes bajo tratamiento combinado o en monoterapia con antiTNF. (6)
ELECCIÓN DEL INMUNOSUPRESOR (INM)
Los datos disponibles hacen aconsejable la utilización de tiopurinas como INM cuando se valora el tratamiento combinado con antiTNF, independientemente de si el paciente había presentado o no fracaso previo. (6)
El uso de metotrexato (MTX) en la EII suele reservarse para los casos con intolerancia o ineficacia de las tiopurinas.(53) El uso de MTX junto a antiTNF no ha demostrado un aumento de la eficacia clínica en el único estudio controlado realizado con IFX (54) aunque el uso concomitante de corticoides hace que sea difícil la interpretación del estudio. Existen evidencias de su efecto en reducir la inmunogenicidad frente a IFX cuando se administra de forma episódica con una eficacia similar a tiopurinas.(55) También puede ayudar a recuperar la pérdida de respuesta secundaria (56) por lo que su uso podría estar indicado en esta situación. (53) No obstante, estos datos son únicamente con IFX por lo que no es posible una extrapolación de los resultados al ADA; siendo este contexto clínico (pérdida de respuesta secundaria a ADA con presencia de AAA) un campo de futura investigación.
APLICACIÓN EN LA PRÁCTICA CLÍNICA
La elección de la mejor estrategia de tratamiento tiene que ser equilibrada entre los beneficios y los riesgos potenciales de infección y cáncer, paciente por paciente y sin olvidar el coste económico. La estratificación según la gravedad de la enfermedad, podría identificar a pacientes que se beneficiarían del tratamiento combinado.
En el contexto actual donde el coste farmacológico en los pacientes con EII ha superado el de las hospitalizaciones y la cirugía y; debido a los presupuestos limitados, sería un error abandonar el uso de las tiopurinas ya que se trata de fármacos baratos, con un perfil riesgo/beneficio bien conocido y favorable y que pueden mantener a una quinta parte de los pacientes en remisión clínica libre de esteroides a largo plazo. (57)
En los casos de enfermedad de Crohn corticodependiente no grave, el tratamiento de elección inicial deberían ser las tiopurinas en monoterapia, con una monitorización precoz de la eficacia clínica (3-6 meses) para considerar un cambio terapéutico en ausencia de la misma. En estos casos de ineficacia, así como en pacientes con intolerancia a tiopurinas con actividad no severa, la monoterapia con ADA podría ser una buena opción.
En los casos de enfermedad de Crohn corticorrefractaria o corticodependiente grave, el tratamiento con fármacos antiTNF estaría indicado. En el caso del ADA, sin estudios controlados comparando la eficacia de la monoterapia frente al tratamiento combinado, éste último en la inducción, presenta una discreta superioridad en eficacia junto con un mejor perfil inmunogénico por lo que sería de elección. Sin embargo, existe una población de alto riesgo de efectos adversos como son los pacientes mayores de 65 años, los varones jóvenes (< 35 años) con serología virus Epstein Barr (VEB) negativa y los pacientes con antecedentes de neoplasia, donde el balance riesgo/beneficio podría hacernos optar por una monoterapia sin INM de entrada.
En otras ocasiones, las características de los pacientes además de la gravedad de la enfermedad, pueden decantar la balanza hacia una monoterapia con antiTNF como en una enfermedad ileal limitada (<15 cm longitud) y en la prevención de la recurrencia postquirúrgica; o bien a un tratamiento combinado como en los brotes agudos en pacientes con resección intestinal previa.
Después de al menos 6 meses de tratamiento combinado, en los casos en remisión clínica, el cambio a monoterapia con ADA debería valorarse nuevamente paciente a paciente según riesgo/beneficio ya que no existe suficiente evidencia para recomendar un tratamiento combinado con ADA e INM de mayor duración.
En casos de pérdida de respuesta a ADA o fracaso de la monoterapia, el tratamiento combinado con tiopurinas podría ser una opción previa a la intensificación en un intento de mejorar la inmunogenicidad. Igualmente, en casos de intensificación, la asociación de IMM podría ser valorada individualmente en grupos de bajo riesgo.
La decisión final sobre la pauta de tratamiento debería ser consensuada con el propio paciente ya que debe participar activamente en la toma de decisiones.(7) Sin embargo, la transmisión de la información no siempre es factible y fácil. Disponemos de una página de internet que compara ambas estrategias de tratamiento en EC (http://www.optiongrid.org) que, si bien puede ayudar para aclarar las preguntas más frecuentes, no permite una correcta estratificación del riesgo individual.
BIBLIOGRAFÍA
1. Peyrin-Biroulet L, Loftus EV Jr, Colombel JF, Sandborn WJ. The natural history of adult Crohn´s disease in population-based cohorts. Am J Gastroenterol 2010; 105: 289-97
2. Cosnes J, Nion-Larmurier I, Beaugerie L, Afchain P, Tiret E, Gendre JP. Impact of the increasing use of immunosuppressants in Crohn´s disease on the need for intestinal surgery. Gut 2005; 54: 237-41
3. Panaccione R, Hibi T, Peyrin-Biroulet L, Schreiber S. J Crohns Colitis 2012; 6 (Suppl 2): S235-42
4. Bressler B, Siegel CA. Beware of the swimging pendulum: anti-tumor necrsosis factor monotherapy vs combination therapy for inflammatory bowel disease. Gastroenterology 2014; 146: 884-7
5. Orme ME, Macgilchrist KS, Mitchell S, Spurden D, Bird A. Systematic review and network meta-analysis of combination and monotherapy treatments in disease-modifying antirheumatic drug-experienced patients with rheumatoid arthritis: analysis of American College of Rheumatology criteria scores 20, 50 and 70. Biologics 2012; 6: 429-64
6. Cabriada JL, Vera I, Domènech E, Barreiro-de Acosta M, Esteve M, Gisbert JP et al. Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa sobre el uso de fármacos antifactor de necrosis tumoral en la enfermedad inflamatoria intestinal (2013). Gastroenterol Hepatol 2013; 36: 127-46
7. Dignass A, Van Assche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF et al. The second European evidence-based Consensus on the diagnosis and management of Crohn´s disease: current management. J Crohns Colitis 2010; 4: 28-62
8. Papadakis KA. Adalimumab for the treatment of Crohn´s disease. Expert Rev Clin Immunol 2006; 2:11-5
9. Dulai PS, Siegel CA, Colombel JF, Sandborn WJ, Peyrin-Biroulet L. Systematic review: Monotherapy with antitumor necrosis factor alfa agents versus combination therapy with an immunosuppressive for IBD. Gut 2014; 63: 1843-53
10. Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D et al. Infliximab, azathioprine or combination therapy for Crohn´s disease. N Engl J Med 2010; 362: 1383-95
11. Hanauer S, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, Macintosh D, et al. Human Anti-tumor necrosis factor monoclonal antibody (Adalimumab) in Crohn´s disease: the CLASSIC-I trial. Gastroenterology 2006; 130: 323-33
12. Sandborn WJ, Hanauer SB, Rutgeerts P, Fedorak RN, Lukas M, Macintosh D et al. Adalimumab for maintenance treatment of Crohn´s disease: results of the CLASSIC II trial. Gut 2007; 56: 1232-9
13. Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Colombel JF, Panaccione R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med 2007; 146: 829-38
14. Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn´s disease: the CHARM trial. Gastroenterology 2007; 132:52-65
15. Rutgeerts P, Van Assche G, Sandborn WJ, Wolf DC, Geboes K, Colombel JF et al. Adalimumab induces and maintains mucosal healing in patients with Crohn´s disease: Data from the EXTEND trial. Gastroenterology 2012; 142:1102-11
16. Reenaers C, Louis E, Belaiche J, Seidel L, Keshav S, Travis S. Does co-treatment with immunosuppressors improve outcome in patients with crohn´s disease treated with adalimumab? Aliment Pharmacol Ther 2012; 36: 1040-8
17. Löfberg R, Louis EV, Reinisch W, Robinson AM, Kron M, Camez A, Pollack PF. Adalimumab produces clinical remission and reduces extraintestinal manifestations in Crohn´s disease. Results from CARE. Inflamm Bowel Dis 2012; 18: 1-9
18. Peters CP, Eshuis EJ, Toxopeüs FM, Hellemons ME, Jansen JM, D´Haens GR et al. Adalimumab for Crohn´s disease: long-term sustained benefit in a population-based cohort of 438 patients. J Crohns Colitis 2014; 8: 866-75
19. Baert F, Glorieus E, Reenaers C, D´Haens G, Peeters H, Franchimont D, et al. Adalimumab dose escalation and dose de-escalation success rate and predictors in a large national cohort of Crohn´s patients. J Crohns Colitis 2013; 7:154-60
20. Chaparro M, Panés J, García V, Merino O, Nos P, Domènech E, et al Long-term durability of response to adalimumab in Crohn´s disease. Inflamm Bowel Dis 2012; 18: 685-90
21. Cohen RD, Lewis JR, Turner H, Harrell LE, Hanauer SB, Rubin DT. Predictors of adalimumab dose escalation in patients with Crohn´s disease at a tertiary referral center. Inflamm Bowel Dis 2012; 18: 10-6
22. Kamm MA, Hanauer SB, Panaccione R, Colombel JF, Sandborn WJ, Pollack PF, et al. Adalimumab sustains steroid-free remission after 3 years of therapy for crohn´s disease. Aliment Pharmacol Ther 2011; 34: 306-17
23. Peyrin-Biroulet L, Laclotte C, Bigard MA. Adalimumab maintenance therapy for Crohn´s disease with intolerance or lost response to infliximab: an open-label study. Aliment Pharmacol Ther 2007; 15: 675-80
24. Allez M, Vermeire S, Mozziconacci N, Michetti P, Laharie D, Louis E, et al. The efficacy and safety of a third anti-TNF monoclonal antibody in crohn´s disease after failure of two other anti-TNF antibodies. Aliment Pharmacol Ther 2010; 31: 92-101
25. Kopylov U, Al-Taweel T, Yaghoobi M, Nauche B, Bitton A, Lakatos PL, et al. Adalimumab monotherapy versus combination therapy with immunomodulators in patients with Crohn´s disease: a systematic review and meta-analysis. J Crohns Colitis 2014; 8: 1632-41
26. Jones J, Kaplan GG, Peyrin-Biroulet L, Baidoo L, Devlin S, Melmed GY, et al. Impact of concomitant immunomodulator treatment on efficacy and safety of anti-TNF therapy in Crohn´s disease: a meta-analysis of placebo controlled trials with individual patient-level data. Gastroenterology 2013; 144: S-179
27. Roblin X, Serre-Debeauvais F, Phelip JM, Bessard G, Bonaz B. Drug interaction between infliximab and azathioprine in patients with crohn´s disease. Aliment Pharmacol Ther 2003; 18:917-25
28. Wong DR, Pierik M, Seinen ML, Van Bodegraven AA, Gilissen LP, Bus P et al. The pharmacokinetic effect of adalimumab on thiopurine metabolism in Crohn´s disease patients. J Crohns Colitis 2014; 8: 120-8
29. Kariyawasam VC, Ward MG, Blaker PA, Mogan SB, Kubota Y, Anderson S et al. Azathioprine decreases the risk of adalimumab primary non-response and secondary loss of response but only if adequately dosed. J Gastroenterol Hepatol 2013; 28(Suppl2):109
30. Ong DE, Kamm MA, Hartono JL, Lust M. Addition of thiopurines can recapture response in patients with Crohn´s disease who have lost response to anti-tumor necrosis factor monotherapy. J Gastroenterol Hepatol 2013; 28: 1595-9
31. Ordas I, Feagan BG, Sandbrn WJ. Therapeutic drug monitoring of tumor necrosis fctor antagonists in inflammatory bowel disease. Clin Gastroenterol Hepatol 2012; 10: 1079-87
32. Karmiris K, Paintaud G, Noman M, Magdelaine-Beuzelin C, Ferrante M, Degenne D, et al. Influence of trough serum levels and immunogenicity on long-term outcome of adalimumab therapy in Crohn´s disease. Gastroenterology 2009; 137: 1628-40
33. Wang SL, Hauenstein S, Ohrmund L, Shringarpure R, Salbato J, Reddy R, et al. Monitoring of adalimumab and antibodies-to-adalimumab levels in patient serum by the homogeneous mobility shift assay. J Pharm Biomed Anal 2013; 78: 39-44
34. Chiu YL, Rubin DT, Vermeire S, Louis E, Robinson AM, Lomax KG, et al. Serum adalimumab concentration and clinical remission in patients with Crohn´s disease. Inflamm Bowel Dis 2013; 19: 1112-22
35. Van Schaik T, Maljaars JP, Roopram RK, Verwey MH, Ipenburg N, Hardwick JC, et al. Influence of combination therapy with immune modulators on anti-TNF trough levels and antibodies in patients with IBD. Inflamm Bowel Dis 2014; 20: 2292-8
36. Mazor Y, Almog R, Kopylov U, Ben Hur D, Blatt A, Dahan A, et al. Adalimumab drug and antibody levels as predictors of clinical and laboratory response in patients with crohn´s disease. Aliment Pharmacol Ther 2014; 40: 620-8
37. Krieckaert CL, Nurmohamed MT, Wolbink GJ. Methotrexate reduces immunogenicity in adalimumab treated rheumatoid arthritis patients in a dose dependent manner. Ann Rheum Dis 2012; 71: 1914-5
38. Burmester GR, Kivitz AJ, Kupper H, Arulmani U, Florentinus S, Goss SL, et al. Efficacy and safety of ascending methotrexate dose in combination with adalimumab: the randomised CONCERTO trial. Ann Rheum Dis 2014 published online first
39. Singh JA, Wells GA, Christensen R, Tanjong E, Maxewll L, MacDonald JK, et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev 2011;2:CD008794
40. Cottone M, Kohn A, Daperno M, Armuzzi A, Guidi L, D´Inca R, et al. Advanced age is an independent risk factor for severe infections and mortality in patients given anti-tumor necrosis factor therapy for inflammatory bowel disease. Clin Gastroenterol Hepatol 2011; 9: 30-5
41. Sandborn, W., et al. “Concomitant use of adalimumab and immunomodulators or corticosteroids compared with adalimumab alone: Pooled safety analysis.: P 161.” Inflamm Bowel Dis 2011;17:S61
42. D´Haens GD, Reinisch W, Satsangi J, Loftus EVJr, Panaccione R, Castillo M, et al. PYRAMID Registry: an observacional study of adalimumab in Crohn´s disease: results at year 5. Am J Gastroenterol 2013;108: S506
43. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohn’s Colitis 2014;8:443-68
44. Williams CJ, Peyrin-Biroulet L, Ford AC. Systematic review with mata-analysis: malignancies with anti-tumour necrosis factor alfa therapy in inflammatory bowel disease. Aliment Pharmacol Ther 2014; 39: 447-58
45. Andersen NN, Pasternak B, Basit S, Andersson M, Svanström H, Caspersen S, et al. Association between tumor necrosis factor alfa antagonists and risk of cancer in patients with inflammatory bowel disease. JAMA 2014; 311: 2406-13
46. Osterman MT, Sandborn WJ, Colombel JF, Robinson AM, Lau W, Huang B, et al. Increased risk of malignancy with adalimumab combination therapy compared with monotherapy for Crohn´s disease. Gastroenterology 2014; 146: 941-9
47. Peyrin-Biroulet L, Khosrotehrani K, Carrat F, Bouvier AM, Chevaux JB, Simon T, et al. Increased risk for nonmelanoma skin cancers in patients who receive thiopurines for inflammatory bowel disease. Gastroenterology 2011; 141: 1621-8
48. Long MD, Herfarth HH, Pipkin CA, Porter CQ, Sandler RS, Kappelman MD. Increased risk for non-melanoma skin cancer in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2010; 8: 268-74
49. Singh H, Nugent Z, Demers AA, Bernstein CN. Increased risk of nonmelanoma skin cancers among individuals with inflammatory bowel disease. Gastroenterology 2011; 141: 1612-20
50. Beaugerie L, Brousse N, Bouvier AM, Colombel JF, Lèmann M, Cosnes J, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374: 1617-25
51. Kotlyar DS, Lewis JD, Beaugerie L, Tierney A, Brensinger CM, Gisbert JP, et al. Risk of Lymphoma in Patients With Inflammatory Bowel Disease Treated With Azathioprine and 6-Mercaptopurine: A Meta-analysis. Clin Gastroenterol Hepatol 2015;13(5):847-58.
52. Kotlyar DS, Osterman MT, Diamond RH, Porter RH, Blonski WC, Wasik M, et al. A systematic review of factors that contribute to hepatosplenic T-cell lymphoma in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2011;9(1): 36-41
53. Gomollón F, Rubio S, Charro M, García-López S, Muñoz F, Gisbert JP, et al. Recomendaciones del Grupo Español de Trabajo de Enfermedad de crohn y Colitis Ulcerosa (GETECCU) sobre el uso de metotrexato en la enfermedad inflamatoria intestinal. Gastroenterol Hepatol 2015; 38: 24-30
54. Feagan BG, McDonald JW, Panaccione R, Enns RA, Bernstein CN, Ponich TP, et al. Methotrexate in combination with infliximab is no more effective tan infliximab alone in patients with crohn´s disease. Gastroenterology 2014; 146: 681-8
55. Vermeire s, Noman M, Van Assche G, Baert F, D´Haens G, rutgeerts P. Effectiveness of concomitant immunosuppressive therapy in suppressing the formation of antibodies to infliximab in crohn´s disease. Gut 2007; 56: 1226-31
56. Ben-Horin S, Waterman M, Kopylov U, Yavzori M, Picard O, Fudim E et al. addition of an immunomodulator to infliximab therapy eliminates antidrug antibodies in serum and restores clinical response of patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11: 444-7
57. Louis E, Irving P, Beaugerie L. Use of azathioprine in IBD: modern aspects of an old drug. Gut 2014; 63: 1695-9

